
【题目】今年,甲型H1N1流感病毒在许多国家发生,治疗该病毒的有效药物达菲是从八角茴香中经过多道复杂工艺提炼出来的,它的有效成分是莽草酸,化学式为C7H10O5.对莽草酸的下列说法错误的是( )
A. 莽草酸是有机化合物
B. 莽草酸由碳、氢、氧三种元素组成
C. 莽草酸的相对分子质量为174
D. 莽草酸中含有7个碳原子、10个氢原子和5个氧原子
科目:初中化学 来源: 题型:
【题目】水在一定条件下可发生图所示的转化。下列说法正确的个数有( )
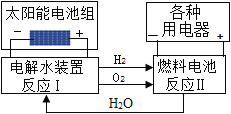
①反应Ⅰ为分解反应,反应Ⅱ为化合反应
②只有反应Ⅰ能说明水由氢和氧元素组成
③整个转化过程中,循环利用的物质是水
④水在解决能源危机中可发挥重要的作用
A. 1 B. 2 C. 3 D. 4
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所示为实验室中常见的气体制备和收集装置。
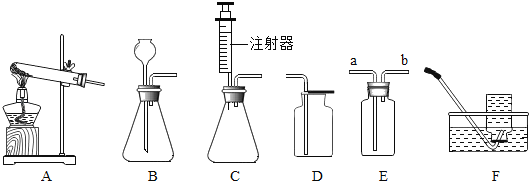
请回答下列问题:
(1)实验室用高锰酸钾制取氧气,应选用发生装置_____(填字母序号),实验时该装置试管口应放一团棉花,其目的是_____,反应的化学方程式为_____。若用装置D收集氧气,验满的方法是_____。
(2)实验室用大理石和稀盐酸制取二氧化碳,若选用C做发生装置,你认为选用C的优点是_____,反应的化学方程式为_____。
(3)欲使用装置E用排空气法收集氧气,则气体应从_____(填“a”或“b”)端通入;欲使用装置E用排水法收集氧气,先将瓶中装满水,再将气体从_____(填“a”或“b”)端通入。
(4)选用F装置收集气体时,下列实验操作不正确的是_____(填序号)。
a 加热前,将集气瓶装满水,用玻璃片盖住瓶口,倒立在盛水的水槽中
b 加热后,观察到水中导管口开始有气泡时,立即收集气体
c 待气泡从集气瓶口逸出时,在水面下用玻璃片盖住瓶口,移出水槽正放在桌面上
(5)已知甲烷(CH4)是一种无色无味、密度比空气小、难溶于水的气体,实验室常用加热无水醋酸钠与碱石灰的混合物来制取,则实验室制取并收集甲烷应选择的装置组合为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙、丙、丁是初中化学常见的四种物质,甲属于常见的酸,乙是相对分子质量最小的氧化物。它们相互之间的关系如图所示(“—”表示两种物质之间可以相互反应,“→”表示一种物质可生成另一种物质。)
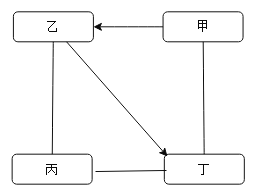
(1) 乙生成丁的化学方程式___________________________。
(2) 丙与丁反应的化学方程式__________________________。
(3) 甲与丁反应的微观实质为_________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】世界卫生组织把铝元素列为食品污染源之一,成人每日摄入铝元素的量应控制在0.004g以下。油条是我国许多地方的传统早点,每270g中含0.9 g明矾(KAl(SO4)2·12H2O)。计算: 试通过计算说明,若每日食用约150 g油条,请问铝元素的摄人量是否超过安全摄入量。 ______________(写计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(8分)碲(Te)被誉为“现代工业、国防与尖端技术的维生素,创造人间奇迹的桥梁”。实验室模拟提取碲的一个实验是:取某含碲溶液于烧瓶中,加入适量NaC1,加热到一定温度,持续通入SO2,待反应一定时间,过滤得到粗碲。
(1)反应的总化学方程式为:
![]()
则X为________(填化学式)。
(2)为探究获得较高粗碲沉淀率的反应条件,某研究小组在控制NaC1浓度和SO2流量不变的条件下,进行下述对比试验,数据如下:
实验 | 温度/℃ | 反应时间/h | 粗碲沉淀率/% |
a | 65 | 3.0 | 65.0 |
b | 80 | 3.0 | 98.9 |
c | 80 | 2.0 | 98.9 |
d | 90 | 2.0 | 97.0 |
①该小组研究的反应条件是______________和_________________。
②实验a和b 的目的是___________________________。
③在上述四组实验中,最佳的反应条件是__________℃和__________h。
④为了提升设备利用效率和节约能源,可进一步优化反应条件测定粗碲沉淀率。若再设计对比实验,选择的反应条件还可以是___________(填选项)。
A.80℃,1.5h B.80℃,2.5h
C.70℃,2.0h D.95℃,2.0h
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】现有一瓶标签已破损的过氧化氢溶液,为测定瓶内溶液中溶质的质量分数,取该溶液34g于烧杯中,加入一定量的二氧化锰,完全反应后,称得烧杯内剩余物质的总质量是34.4g,将烧杯内剩余物质过滤、洗涤、干燥后得滤渣2g。则瓶内过氧化氢溶液中溶质的质量分数是____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】工业上利用铁锰矿(主要成分MnO2)制备高锰酸钾的流程如图所示,回答下列问题:(信息提示:MnO2不溶于水,含钾化合物均可溶于水)
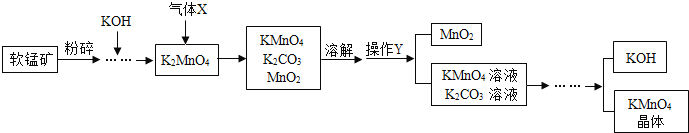
(1)将铁锰矿粉碎的目的是_____.
(2)流程中通入的气体X是_____(填标号)
A N2 B CO2 C H2
(3)操作Y的名称是_____.
(4)上述流程中可循环利用的物质有_____.
(5)高锰酸钾可用于实验室制取氧气,反应的化学方程式为_____.
根据化学方程式计算,如果收集到100.0g氧气,理论上需要高锰酸钾的质量为____(计算结果精确到0.1g)
(6)已知铁锰矿中含26.1t纯净的MnO2,可制得31.6tKMnO4,若不考虑物质循环与制备过程中的损失,则参加反应的MnO2与生成的KMnO4的锰原子的个数比为_____(填最简整数比).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com