现有CaO和Ca(OH)2的固体混合物,测得其中氢元素的质量分数为2%.取100g该固体全部溶于足量的水中,再往所得的溶液中加入200g碳酸钠溶液,恰好完全反应.
(1)固体混合物中,Ca(OH)2的质量为;
(2)所用的碳酸钠溶液的质量分数为;
(3)反应完全后过滤,蒸发过滤后所得的溶液,得到固体的质量是多少克?
解:
(1)100g混合物中含氢元素质量为:100g×2%=2g,则氢氧化钙的质量为:2g÷
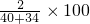
%=74g;氧化钙的质量为:100g-74g=26g.
(2)设26g氧化钙溶于水可得氢氧化钙的质量为x
CaO+H
2O═Ca(OH)
256 74
26g x
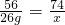
x=34g
则溶液中氢氧化钙的总质量为74g+34.36g=108g,设碳酸钠溶液的溶质质量分数为y,生成的氢氧化钠的质量为z
Ca(OH)
2+Na
2CO
3═CaCO
3↓+2NaOH
74 106 80
108g 200g×y z
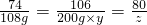
y=77.7% z=117.2g
答:(1)固体混合物中,Ca(OH)
2的质量为74g;
(2)所用的碳酸钠溶液的质量分数为77.7%;
(3)反应完全后过滤,蒸发过滤后所得的溶液,得到固体的质量是117.2克.
分析:(1)根据氢氧化钙中氢元素的质量分数和混合物中氢元素的质量计算氢氧化钙的质量;
(2)根据氧化钙的质量计算出生成的氢氧化钙和原来的氢氧化钙的质量计算碳酸钠的质量,然后计算质量分数;
(3)根据氢氧化钙的质量计算生成的氢氧化钠的质量;
点评:本题主要考查学生灵活地利用元素的质量分数和质量守恒定律解答问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

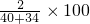 %=74g;氧化钙的质量为:100g-74g=26g.
%=74g;氧化钙的质量为:100g-74g=26g.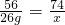
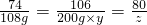


 步步高达标卷系列答案
步步高达标卷系列答案