
分析 (1)最理想的燃料,应具有燃烧无污染、燃烧放出热量多、可再生使用,进行分析解答.
(2)根据活性炭具有吸附性,能吸附异味和色素,进行分析解答.
(3)食品、药品、营养品、矿泉水等物质中的“钙”等不是以单质、分子、原子等形式存在,而是指元素,通常用元素及其所占质量(质量分数)来描述.
(4)熟石灰是氢氧化钙的俗称,写出其化学式即可.
(5)由质量守恒定律:反应前后,原子种类、数目均不变,据此由反应的化学方程式推断反应物X的化学式.
解答 解:(1)煤燃烧会产生二氧化碳、一氧化碳、二氧化硫等气体,会污染空气,产生温室效应;氢气作为燃料:资源丰富,燃烧时释放出的热量多,燃烧的产物只有水,无污染,是最理想的燃料.
(2)活性炭具有吸附性,能吸附异味和色素,在新买的轿车内放入几包活性炭可减少异味,其原理是利用了活性炭的吸附性.
(3)生活中常接触到“高钙牛奶”,其中的“钙”不是以单质、分子、原子等形式存在,这里所指的“钙”是强调存在的元素,与具体形态无关.
(4)熟石灰是氢氧化钙的俗称,其化学式为:Ca(OH)2.
(5)由质量守恒定律:反应前后,原子种类、数目均不变,由反应的化学方程式2NaOH+X=NaClO+NaCl+H2O,反应前钠、氢、氧、氯原子个数分别为2、2、2、0,反应后的生成物中钠、氢、氧、氯原子个数分别为2、2、2、2,根据反应前后原子种类、数目不变,则每个X分子由2个氯原子构成,则物质X的化学式为Cl2.
故答案为:(1)氢气;(2)吸附性;(3)元素;(4)Ca(OH)2;(5)Cl2.
点评 本题难度不大,掌握常见燃烧燃烧对环境的影响、活性炭具有吸附性、质量守恒定律等并能灵活运用是正确解答本题的关键.


科目:初中化学 来源: 题型:推断题
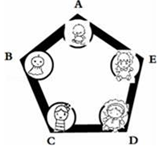 兴趣小组把A、B、C、D、E围成如图所示的“化学游乐城”,已知盐酸、硫酸、氢氧化钠、氯化钡和碳酸钠是五种物质的选项,游娱规则为只有相邻物质间能发生反应才能组成守护防线(如图所示),其中物质A常用于铅酸蓄电池中,其浓溶液有脱水性;物质C是人体胃液中的主要成分(提示:碳酸钡不溶于水)
兴趣小组把A、B、C、D、E围成如图所示的“化学游乐城”,已知盐酸、硫酸、氢氧化钠、氯化钡和碳酸钠是五种物质的选项,游娱规则为只有相邻物质间能发生反应才能组成守护防线(如图所示),其中物质A常用于铅酸蓄电池中,其浓溶液有脱水性;物质C是人体胃液中的主要成分(提示:碳酸钡不溶于水)查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
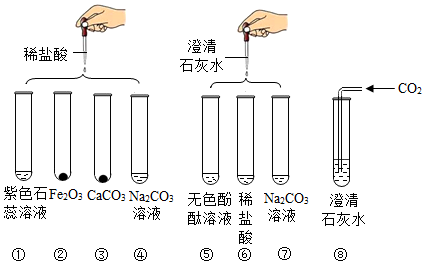
| 步骤 | 操作 | 现象 | 结论 |
| 第一步 | 取样,加入少量盐酸 | 无气泡产生 | 废液中一定没有碳酸钠 |
| 第二步 | 再次取样,进行实验⑧ | 无白色沉淀产生 | 废液中只有氢氧化钠 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 药品取用:将试管竖直,垂直放入锌粒 | |
| B. | 区别物质:用pH试纸可以区别两种不同浓度的NaCl溶液 | |
| C. | 气体净化:除去CO2中混有的少量CO,可通入O2点燃 | |
| D. | 气体收集:CO2和O2密度比空气大,故都能用向上排空气法收集 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 向某无色溶液中滴入紫色石蕊试液,呈红色,证明该溶液是酸溶液 | |
| B. | 向某无色溶液中滴入硝酸钡溶液,产生白色沉淀,证明该溶液是硫酸 | |
| C. | 某白色固体与熟石灰混合后加热,产生可使湿润的红色石蕊试纸变蓝色的气体, 证明该固体是铵盐 | |
| D. | 把燃着的木条伸入某无色气体的集气瓶中,火焰熄灭,证明该气体是二氧化碳 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题

| A. | 洗气瓶乙中浓硫酸的作用是干燥氢气 | |
| B. | 丙装置中的氧化铜没有完全被还原,会影响实验结果 | |
| C. | 实验中,通过测定丙、丁装置质量的改变值,就能达到测定水的组成的目的 | |
| D. | 该装置存在缺陷,应该在丁装置后再连接一个盛碱石灰的干燥管 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
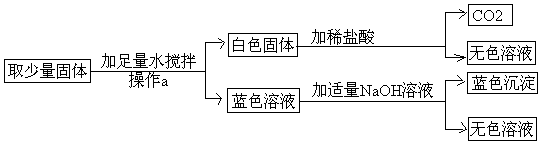
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
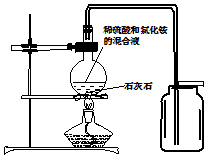 实验室通常不选用稀硫酸和石灰石反应制取二氧化碳,原因是生成的硫酸钙是一种微溶物,会覆盖在石灰石的表面,阻止反应的进一步进行.某小组经过研究,用如图所示方法成功制得了大量CO2(反应物为稀硫酸和石灰石).
实验室通常不选用稀硫酸和石灰石反应制取二氧化碳,原因是生成的硫酸钙是一种微溶物,会覆盖在石灰石的表面,阻止反应的进一步进行.某小组经过研究,用如图所示方法成功制得了大量CO2(反应物为稀硫酸和石灰石).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com