
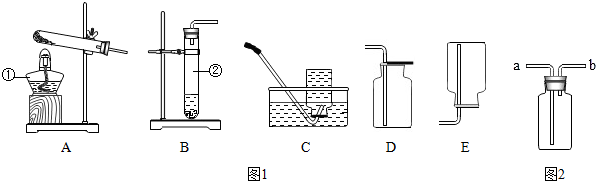
分析 (1)据常用仪器回答;
(2)B装置是固液常温型制取气体的装置,实验室利用过氧化氢分解制取氧气可用此发生装置,据反应原理书写方程式,氧气密度比空气大且不易溶于水,所以可用向上排空气法或排水法收集;
(3)据反应物状态和反应条件选择发生装置,据气体密度和溶解性选择收集装置,氨气密度比空气小,应从短管进入,氨气极易溶于水,可用水吸收尾气.
解答 解:(1)标号仪器分别是加热的酒精灯和作为反应容器的试管;
(2)B装置是固液常温型制取气体的装置,实验室利用过氧化氢分解制取氧气可用此发生装置,过氧化氢在二氧化锰催化作用下生成水和氧气,反应方程式是:
2H2O 2$\frac{\underline{\;MnO_2\;}}{\;}$2H 2O+O 2↑;氧气密度比空气大且不易溶于水,所以可用向上排空气法或排水法收集;
(3)用加热氯化铵晶体和氢氧化钙粉末来制取氨气属于固体加热型,故选发生装置A,氨气密度比空气小,极易溶于水,所以只能用向下排空气法收集;氨气密度比空气小,应从短管进入,氨气极易溶于水,所以可用水吸收尾气进行处理;
故答案为:(1)酒精灯; 试管;
(2)2H2O 2$\frac{\underline{\;MnO_2\;}}{\;}$2H 2O+O 2↑;C(或D);
(3)A; E; b; 水.
点评 明确实验室制取氧气的装置选取、反应原理等知识,即可结合题意正确解答,难度不大.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
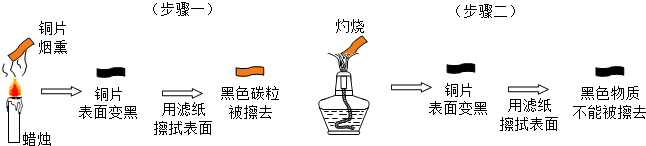
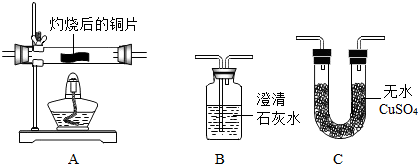
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
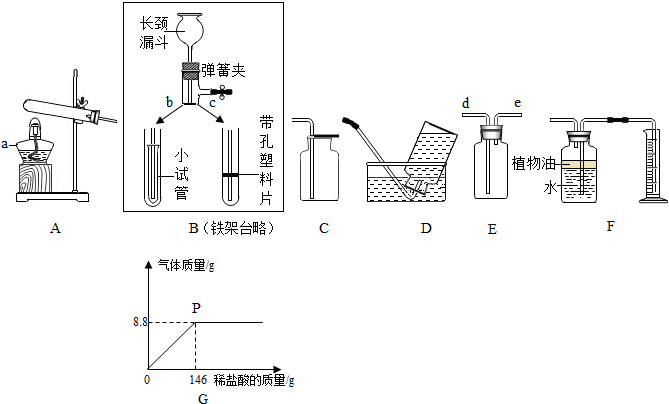
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
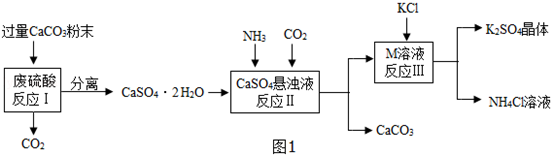
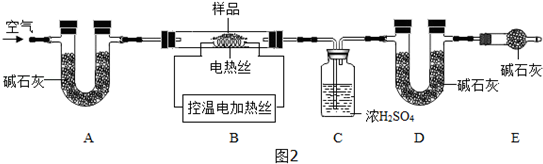
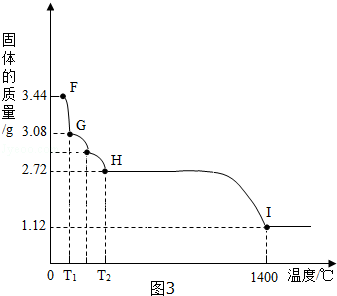
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com