
某同学利用以下药品:长、宽和厚度均相同的锌片、铁片与铜片、稀硫酸、硫酸亚铁溶液、硫酸铜溶液、硫酸锌溶液、锌粉,验证锌、铁、铜的金属活动性顺序.
(1)实验前,用砂纸打磨金属片的目的是 ;
(2)根据实验目的,该同学设计了实验I、Ⅱ两种合弹的方案,如图l所示:
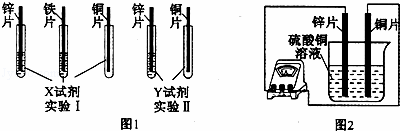
若X、Y是两种不同的试剂,则X、Y中溶质的化学式依次为 、 ;
(3)该同学将硫酸亚铁溶液和硫酸铜溶液混合在一起,溶液呈现青色.
A.向混合液中加入过量锌粉,搅拌,溶液颜色的变化应为:青色变浅至 色,最终变为无色;
B.向混合注中插人锌片,待其浸没部分表面完全变色后,溶液仍为青色,取下锌片表面附着的粉末,经检验其组成为铁和铜.粉末中存在铁的原因:
①反应生成了铁,写出该反应的化学方程式: ;
② ;
(4)如图2所示,该同学用导线将锌片和铜片连接起来,接入电流表,然后把它们一起插入硫酸铜溶液中,该实验的现象为:①电流表 ;②铜片表面 .
【答案】(1) 除去金属表面的氧化膜 ;(2) H2SO4 、 FeSO4 ;
(3)A. 浅绿色 ;B.① Zn+FeSO4=ZnSO4+Fe ;
② 铜和锌构成原电池,电子转移过程中亚铁离子得到电子变成铁单质 ;
(4)① 指针发生偏转 ;② 变粗 .
【解析】
试题分析:(1)金属在空气中其表面能生成一层氧化膜,氧化膜会阻止金属与药品的接触,所以要先除去氧化膜;
(2)实验1:给定三种金属,因此可以和酸混合:将三种金属分别于稀硫酸混合后,铜与稀硫酸不反应,锌、铁均能与稀硫酸反应产生气体,且锌的反应比铁剧烈,可以得出锌>铁>铜;
实验2,给定两种金属,可以和中间金属的盐溶液混合,由于锌能与硫酸亚铁反应,说明锌在铁的前面,铜不与硫酸亚铁反应,说明铁在铜的前面.所以可以选用的另外一种药品是硫酸亚铁溶液;
(3)A、硫酸亚铁溶液是浅绿色,硫酸铜溶液是蓝色,离子溶液混合后 呈现青色,加入过量锌粉后,先和硫酸铜发生置换反应,青色变浅;硫酸铜完全反应后,溶液变为浅绿色;接着锌再和硫酸亚铁发生置换反应,变成硫酸锌,溶液呈现无色;
呈现青色,加入过量锌粉后,先和硫酸铜发生置换反应,青色变浅;硫酸铜完全反应后,溶液变为浅绿色;接着锌再和硫酸亚铁发生置换反应,变成硫酸锌,溶液呈现无色;
B、混合盐溶液中插入锌片,铁单质可能有离子来源:当溶液中铜离子的浓度很稀时,锌与硫酸亚铁直接发生置换反应,反应的方程式为:Zn+FeSO4=ZnSO4+Fe;也可能是铜和锌构成原电池,电子从锌片转移到 铜片上时,溶液中的铜离子、亚铁离子得到电子变成铜单质和铁单质;
铜片上时,溶液中的铜离子、亚铁离子得到电子变成铜单质和铁单质;
(4)原电池中锌比铜活泼,所以锌失去电子,电子从锌片流向铜片,而电流从铜片流向锌片,所以电流表指针发生偏转;铜离子在铜片上得到电子,生成红色的铜单质,故锌片变薄,铜片表面变粗.


 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案科目:初中化学 来源: 题型:
小明发现家中一枚戒指生满了铜绿,他和同学利用这枚戒指展开了研究性学习。
[查阅资料]
①真金在空气中不会生锈,生满铜绿的“金戒指”材质为铜锌合金;
②铜长期露置在潮湿的空气中能生成铜绿,其主要成分是碱式碳酸铜[Cu2(OH)2CO3],碱式碳酸铜受热易分解生成CuO、H2O和CO2 。据上述资料可推知,碱式碳酸铜由 ▲ 种元素组成。
[实验探究]
将该枚生满铜绿的戒指加入过量稀盐酸中,有气泡产生,溶液由无色逐渐变为蓝绿色。
(1)小明认为:气体中除了含有CO2外,还可能含有的气体是 ▲ 。产生该气体的化学反应方程式为 ▲ 。
(2)小华认为蓝绿色溶液中除含有氯化锌外,还应该含有 ▲ 、 ▲ 。他取适量上述蓝绿色溶液,加入光亮的铁片,观察到了现象:① ▲ ,② ▲ ,从而证实了自己的观点。
(3)小娟取适量新制的FeCl2溶液,加入锌粒,一 段时间后,溶液颜色变浅。发生反应的化学方程式为 ▲ 。结合小华的实验可推知:铁、锌、铜三种金属的活动性由弱到强的顺序是 ▲ 。
段时间后,溶液颜色变浅。发生反应的化学方程式为 ▲ 。结合小华的实验可推知:铁、锌、铜三种金属的活动性由弱到强的顺序是 ▲ 。
(4)小明想进一步探究“金戒指”中铜元素的质量分数,取一枚同材质的“金戒指”,称得质量为3.8g。在老师的指导下,将“金戒指”经浓硝酸氧化、碱化等步骤处理后,最终得到纯净的氧化铜,称得质量仍然为3.8g(实验过程中铜元素损失忽略不计)。则“金戒指”中铜元素的质量分数是多少?(写出计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:
(1)农业生产中氯化铵 (能或不能)与草 木灰一起使用,请写出氯化铵与熟石灰反应的方程式 ;
木灰一起使用,请写出氯化铵与熟石灰反应的方程式 ;
(2)工业上用盐酸除铁锈的方程式为 ,若盐酸过量,溶液最终呈
色
(3)实验室用过氧化氢制取氧气的方程式为 。
查看答案和解析>>
科目:初中化学 来源: 题型:
11.2 g某种铁合金样品(只含两种成分)与足量的稀硫酸充分反应后,生成0.44 g氢气,则该铁合金中所含的另一种成分可能是 ( )
A.Cu B.Al C.Zn D.C
查看答案和解析>>
科目:初中化学 来源: 题型:
如表是某研究小组探究影响反应速率部分因素的相关实验数据.
| 实验
| H2O2溶液 浓度/% | H2O2溶液 体积/ml | 温度/℃ | MnO2的 用量/g | 收集氧气 的体积/ml | 反应所需 的时间/s |
| ① | 5 | 1 | 20 | 0.1 | 4 | 49.21 |
| ② | 15 | 1 | 20 | 0.1 | 4 | 16.75 |
| ③ | 30 | 5 | 35 | 2 | 10.76 | |
| ④ | 30 | 5 | 55 | 2 | 6.04 |
原数据
| 实验 序号 | H2O2溶液 浓度/% | H2O2溶液 体积/ml | 温度/℃ | MnO2的 用量/g | 收集氧气 的体积/ml | 反应所需 的时间/s |
| ① | 5 | 1 | 20 | 0.1 | 4 | 16.75 |
| ② | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
| ③ | 30 | 5 | 35 | 2 | 49.21 | |
| ④ | 30 | 5 | 55 | 2 | 10.76 |
(1)通过实验 _________ 和实验 _________ 对比可知(填实验序号),化学反应速率与反应物的浓度有关;从实验③和④对比可知,化学反应速率与 _________ 有关.
(2)用一定量的质量分数为15%的过氧化氢溶液制氧气,在不影响产生氧气质量的前提下,为了减慢反应速率,可采取的措施是 _________ .
查看答案和解析>>
科目:初中化学 来源: 题型:
下列认识或说法中正确的是 ( )
A、向某固体中加入稀盐酸有气泡产生,可证明该物质中一定含有CO32-
B、常温下可用Fe与AgCl反应制取Ag
C、可用过量的Cu(OH)2除去CuSO4溶液中少量的H2SO4
D、分别将Mg、Fe、Cu、Ag放入稀盐酸中,可确定它们的活动性顺序
查看答案和解析>>
科目:初中化学 来源: 题型:
A~G是初中所学的常见物质,其转化关系如下图所示(部分反应物和生成物、反应条件已 略去),A、B常温下为无色气体且组成元素相同,
略去),A、B常温下为无色气体且组成元素相同,
C是大理石的主要成分,D、E均为黑色固体。请回答下列问题:
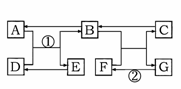
(1)B的化学式:_____________;
(2)反应②的基本反应类型是:________;
(3)写出反应①的化学方程式: _______
_______ _____________________。
_____________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
下列对某一主题的知识归纳,有错误的一组是
| A.物质鉴别 | B |
| 硫酸钾和硫酸铵——熟石灰混合研磨、闻气味 羊毛纤维与合成纤维——灼烧、闻气味 | 盐酸中混有硫酸——加适量氯化钡溶液过滤 木炭粉中混有铁粉——磁铁吸引 |
| C. | D.物质与微粒构成 |
| 电器着火——切断电源,再用干粉灭火器灭火 居室装修——常开窗通风 | 水——由氢原子和氧原子构成 氯化钠——由钠离子和氯离子构成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com