
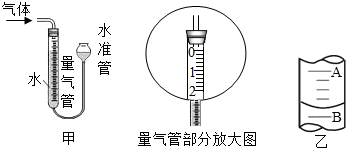
| 编号 | KClO3质量(g) | 其他物质质量(g) | 待测数据 |
| 1 | 2.0 | 不加任何物质 | … |
| 2 | 2.0 | CuO 0.5 | … |
| 3 | 2.0 | MnO2 0.5 | … |
| 实验步骤 | 实验过程及现象 | 设计目的 |
| 1 | 加入CuO后产生O2的速率比未加入时快得多 | CuO能加快KClO3的分解 |
| 2 | CuO的质量在反应前后是否保持不变 | |
| 3 | 将过滤后的CuO重新与KClO3混合加热,观察是否依旧能加快KClO3的分解 |
| 实验步骤 | 实验操作及现象 | 设计目的 |
| 1 | 实验表明,加入CuO后产生O2的速率比未加时快得多 | CuO能加快KClO3的分解 |
| 2 | 将加热后残留的固体溶于足量的水,过滤后称重CuO的质量 | CuO的质量在反应前后是否保持不变 |
| 3 | 将过滤后的CuO重新与KClO3混合加热,观察是否依旧能加快KClO3的分解 | CuO的化学性质在反应前后是否保持不变 |
| ||
| 实验步骤 | 实验操作及现象 | 设计目的 |
| 2 | 将加热后残留的固体溶于足量的水,过滤后称重CuO的质量 | |
| 3 | CuO的化学性质在反应前后是否保持不变 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:
| A、碱一定能使无色的酚酞试液变成红色 |
| B、能生成盐和水的反应一定是中和反应 |
| C、能电离出氢离子的化合物叫做酸 |
| D、水是由水分子构成的 |
查看答案和解析>>
科目:初中化学 来源: 题型:
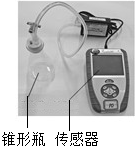 同学们通过查阅资料知道,过氧化氢分解反应的催化剂除二氧化锰外,还有氯化铁溶液和土豆中含有的过氧化氢酶.同学们通过如下实验进行相关研究.
同学们通过查阅资料知道,过氧化氢分解反应的催化剂除二氧化锰外,还有氯化铁溶液和土豆中含有的过氧化氢酶.同学们通过如下实验进行相关研究.| 时间/s 压强/KPa 试剂 | 0 | 60 | 120 | 180 | 240 | 300 |
| 20mL5%的过氧化氢溶液 | 101.86 | 102.99 | 103.42 | 103.67 | 103.99 | 104.00 |
| 加入二氧化锰粉末 | 102.21 | 105.35 | 115.40 | 129.69 | 145.62 | 163.99 |
| 加入氯化铁粉末 | 101.90 | 102.73 | 107.53 | 114.78 | 122.49 | 130.39 |
查看答案和解析>>
科目:初中化学 来源: 题型:
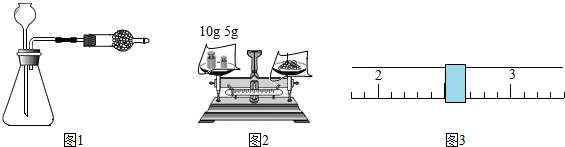
| 时间(s) | [11,28) | [28,47) | [47,62) | [62,74) | [74,88) | [88,103) | [103,118) | [118,135) | [135,154) | [154,176) |
| 质量(g) | 98.0 | 97.9 | 97.8 | 97.7 | 97.6 | 97.5 | 97.4 | 97.3 | 97.2 | 97.1 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 元素 | Na | Mg | Cl | S |
| 离子 | Na+ | Mg2+ | Cl- | S2- |
| 化合价 | +1 | +2 | -1 | -2 |
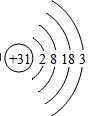
原子结构示意图 | 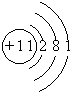 | 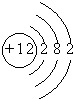 | 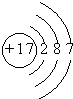 | 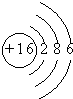 |
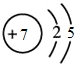
查看答案和解析>>
科目:初中化学 来源: 题型:
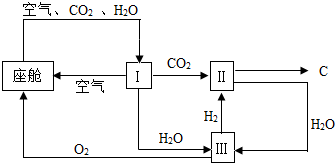
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com