
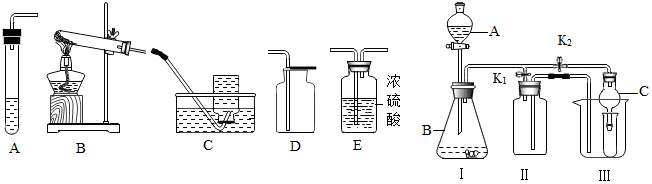
| 制取气体 | 所需要品 | 装置连接顺序 | 反应化学方程式 |
| 干燥的二氧化碳 | 大理石和稀盐酸 | AED | CaCO3+2HCl=CaCl2+H2O+CO2↑ |
分析 制取装置包括加热和不需加热两种,实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热.二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集.如果用双氧水和二氧化锰制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热.氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集.过氧化钠(Na2O2)固体与水反应制取氧气,同时生成氢氧化钠,配平即可;改进措施是:Ⅱ中把左边管加长,右边管变短;硫酸铜可以检验二氧化碳中的水蒸气,现象是:白色变蓝色;对用氯酸钾和二氧化锰的混合物制取O2后的固体残渣,回收二氧化锰的正确操作的先后顺序是:溶解、过滤、洗涤、烘干;过滤、蒸发时都需用到的仪器是玻璃棒;小明用 6.5g 可能含有铜、铝、铁、镁中的一种或几种金属杂质的锌粉,跟足量的稀盐酸完全反应时,生成 0.2g 氢气,则此锌粉中一定含有的金属杂质是铜,因为相同质量的铝、铁、镁都比锌产生的氢气多.
解答 解:(1)实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热.二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集;二氧化碳可以用浓硫酸干燥,故答案为:AED;CaCO3+2HCl=CaCl2+H2O+CO2↑;
(2)当打开 K1、关闭 K2 时,利用 I、Ⅱ装置可直接进行的实验是②,因为氢气的密度比空气小,要短管进入;故答案为:②;
(3)过氧化钠(Na2O2)固体与水反应制取氧气,同时生成氢氧化钠,配平即可;改进措施是:Ⅱ中把左边管加长,右边管变短;故答案为:2Na2O2+2H2O=4NaOH+O2↑;Ⅱ中把左边管加长,右边管变短;
(4)硫酸铜可以检验二氧化碳中的水蒸气,现象是:白色变蓝色;故答案为:硫酸铜;白色变蓝色;
(5)对用氯酸钾和二氧化锰的混合物制取O2后的固体残渣,回收二氧化锰的正确操作的先后顺序是:溶解、过滤、洗涤、烘干;50g×5%=2.5g;过滤、蒸发时都需用到的仪器是玻璃棒;故答案为:bcda;2.5;
(6)小明用 6.5g 可能含有铜、铝、铁、镁中的一种或几种金属杂质的锌粉,跟足量的稀盐酸完全反应时,生成 0.2g 氢气,则此锌粉中一定含有的金属杂质是铜,因为相同质量的铝、铁、镁都比锌产生的氢气多,只有铜不产生氢气,因此可以是铜与铝、铁、镁中的任何一种混合;故答案为:铜;
点评 本考点主要考查了混合物的分离、气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写、气体的检验和有关溶液的计算等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:初中化学 来源: 题型:实验探究题
| 实验步骤和现象 | 实验结论 |
| 取氢氧化钙样品少量,研细后加适量蒸馏水 充分混合后静置,滴加酚酞试液,酚酞试液变红色 | 该样品还含有氢氧化钙 |
查看答案和解析>>
科目:初中化学 来源: 题型:多选题

| A. | 操作X的名称是溶解 | |
| B. | 加热过程中发生的反应一定不是化合反应 | |
| C. | 气体A可能是混合物 | |
| D. | 向黄铜中加入稀盐酸,会产生气泡 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com