
| 沉淀物 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 |
| 开始沉淀 | 1.9 | 4.2 | 9.1 |
| 完全沉淀 | 3.2 | 6.7 | 11.1 |
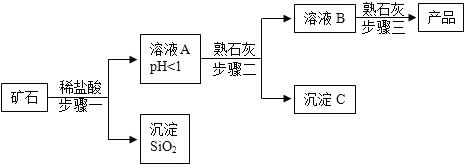
分析 本题考查碱的制备.组成矿石的四种氧化物中仅SiO2不与盐酸反应,其余三种均能反应:
MgO+2HCl═MgCl2+H2O、Fe2O3+6HCl═2FeCl3+3H2O、CuO+2HCl═CuCl2+H2O,溶液A的pH<1,说明反映后溶液呈强酸性,盐酸过量,因此溶液A中的阳离子有Mg2+、Fe3+、Cu2+、H+;要使Mg(OH)2纯度高、损失少,必须把pH控制在氯化铜能完全沉淀、但氯化镁不能沉淀的范围内,即6.7<pH<9.1的范围内;溶液B中一定有氯化镁,则B中加入熟石灰的反应为:Ca(OH)2+MgCl2═CaCl2+Mg(OH)2
解答 解:
(1)氧化镁(氧化铁、氧化铜)和盐酸反应生成氯化镁(氯化铁、氯化铜)和水,故化学方程式为MgO+2HCl═MgCl2+H2O、Fe2O3+6HCl═2FeCl3+3H2O、CuO+2HCl═CuCl2+H2O,
(2)溶液A中共含有4种阳离子,它们是Mg2+、Fe3+、Cu2+、H+;
(3)为保证产品纯度、减少产品损失,并便于操作,溶液B的pH可容许的范围为6.7~9.1,即必须把pH控制在氯化铜能完全沉淀、但氯化镁不能沉淀的范围内.故填:6.7~9.1.
(4)3个步骤中均用到的操作是过滤;
(5)氯化镁和氢氧化钙反应能生成氢氧化镁沉淀和氯化钙,反应的化学方程式为:
MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2.
答案:
(1)MgO+2HCl═MgCl2+H2O;
(2)Mg2+、Fe3+、Cu2+、H+;
(3)6.7~9.1;
(4)过滤
(5)MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2.
点评 化学实验现象是化学实验最突出、最鲜明的部分,也是进行分析推理得出结论的依据,掌握物质的性质和相互之间的反应关系,并有助于提高观察、实验能力.所以,对化学实验不仅要认真观察,还应掌握观察实验现象的方法.


科目:初中化学 来源: 题型:推断题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验方案 | 实验操作 | 实验现象 | 实验结论 |
| 方案一 | 取甲组反应后溶液,滴加过量碳酸钠溶液 | 有气泡产生 | 反应后硫酸溶液过量 |
| 方案二 | 取少量甲组反应后溶液,滴在pH试纸上, | 试纸变色,对比比色卡,pH<7 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | X 的化学式为 H2 | |
| B. | 该反应前后铝元素的化合价由 0 变为+3 | |
| C. | 反应后溶液的质量减小 | |
| D. | 由此说明铝锅不宜长时间盛放碱性食品 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| A | 检验氯化钙溶液中含有稀盐酸 | 取样,加入适量的碳酸钙 |
| B | 区分氢氧化钠溶液和纯碱溶液 | 取样,加入无色酚酞溶液 |
| C | 除去氯化铜溶液中的氯化锌 | 加入过量的锌,过滤 |
| D | 证明氢氧化钠已部分变质 | 取样,加入少量的稀盐酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com