
 发散思维新课堂系列答案
发散思维新课堂系列答案科目:初中化学 来源: 题型:
某工业铁红中混有一种黑色的铁的氧化物杂质,为了解杂质的成分及测定铁红的纯度,化学兴趣小组的同学进行了实验探究。请你参与过程分析与交流。
[查阅资料]
①铁的常见氧化物
氧化亚铁(FeO)黑色固体,ω(Fe)=77.8%; 氧化铁(Fe2O3)红色固体,俗称铁红,
ω(Fe)=70.0%;四氧化三铁(Fe3O4)黑色固体,俗称磁性氧化铁,ω(Fe)=72.4%。
②草酸(乙二酸H2CO4)在浓H2SO4存在下受热分解的化学方程式为:
![]()
[实验准备]
①实验的装置图如下
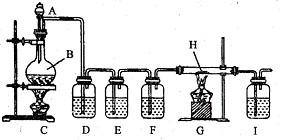
a、草酸 b、工业铁红 c、NaOH溶液 d、澄清石灰水 e、浓H2SO4 f、盐酸
[实验及数据]
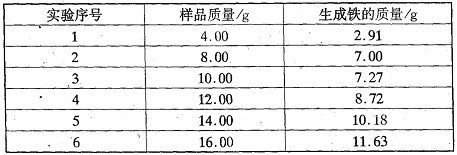
取不同质量的样品进行实验,所得实验数据如下:
讨论与分析]
(1)兴趣小组的同学拟以纯净的CO还原铁的氧化物,所设计的实验装置中D、E、F应分别盛放的试剂为 、 、 、(填写序号,下同),其作用依次是
。
上述装置还有不完善之处,你建议改进措施是
(2)由实验数据不难得出,有—组实验数据不可靠,该组数据是 (填序号),该工业粗铁红所含杂质的化学式为 。
(3)该工业铁红中ω(Fe2O3)= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com