
分析 (1)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答.
(2)根据元素的质量分数的计算方法来分析.
解答 解:(1)根据化合物中各元素质量比=各元素的相对原子质量×原子个数之比,可得蛋氨酸(化学式为C5H11O2NS)中碳、氢、氧、氮、硫五种元素的质量比为(12×5):(1×11):(16×2):(14×1):(32×1)=60:11:32:14:32.故答案为:60:11:32:14:32;
(2)蛋氨酸(化学式为C5H11O2NS)中氮元素的质量分数=$\frac{14}{12×5+1×11+16×2+14+32}$×100%≈9.4%.故答案为:9.4%.
点评 本题难度不大,考查同学们结合新信息、灵活运用化学式的有关计算进行分析问题、解决问题的能力.


科目:初中化学 来源: 题型:选择题
| A. | KMnO4、CuCl2、Fe2(SO4)3 | B. | HCl、AgNO3、Na2SO4 | ||
| C. | NaCl、KNO3、(NH4)2SO4 | D. | H2SO4、K2CO3、NaOH |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 石蜡燃烧 | |
| B. | 久置于空气中的浓硫酸失去了吸水性 | |
| C. | 白磷自燃 | |
| D. | 灯泡通电发光、放热 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 氢氧化物 | Fe(OH)3 | Mg(OH)2 |
| 开始沉淀的pH | 1.5 | 8.6 |
| 完全沉淀的pH | 3.2 | 11.1 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
| 食物 | 苹果 | 葡萄 | 牛奶 | 玉米 |
| PH | 2.9~3.3 | 3.5~4.5 | 6.3~6.6 | 6.8~8.0 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 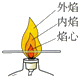 比较火焰各层温度 | B. | 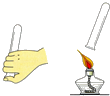 检验氢气纯度 | ||
| C. |  验证CO2的密度比空气大 | D. | 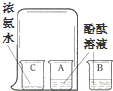 探究分子运动对温度的影响 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
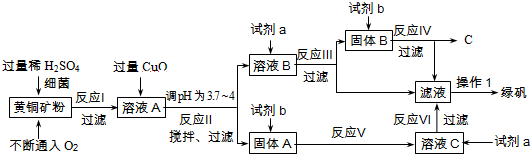
| 沉淀物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 4.7 | 2.7 | 7.6 |
| 完全沉淀pH | 6.7 | 3.7 | 9.6 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 若M为单质,N为化合物,则该反应一定是置换反应 | |
| B. | 数值x与y的和等于m与n的和 | |
| C. | 若该反应是复分解反应,则M、N、P、Q一定是化合物 | |
| D. | 若反应物M失氧,则该反应可能是化合反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com