
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:初中化学 来源:【全国市级联考】重庆市2017届九年级中考模拟(A)化学试卷 题型:信息分析题
饮用水消毒是抑制传染病爆发的有效方法.漂白粉是常用的消毒剂,主要成分是次氯酸钙【Ca(ClO)2】和氯化钙易溶于水.如图为制取漂白粉的工业流程简图:
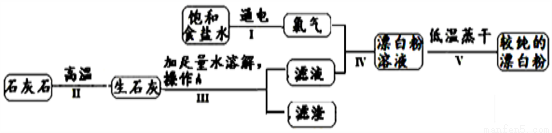
(1)写出步骤Ⅱ中发生反应的化学方程式_________________________________;次氯酸钙中氯元素的化合价为________。
(2)实验室进行操作A时,需要的玻璃仪器有烧杯、漏斗、 ____________。
(3)饱和食盐水电解时发生如下反应:2NaCl+2H2O 2X+H2↑+Cl2↑,请写出X的化学式________________。请写出食盐水的另一日常用途 ____________________。
2X+H2↑+Cl2↑,请写出X的化学式________________。请写出食盐水的另一日常用途 ____________________。
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
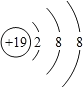
| A. | 该粒子结构属于相对稳定结构 | |
| B. | 该粒子核内有19个质子 | |
| C. | 该粒子属于阳离子 | |
| D. | 该微粒所属的元素位于元素周期表的第三周期 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. |  蒙城牛肉 | B. |  涡阳苔干 | C. |  泾县香菜 | D. |  黄山烧饼 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
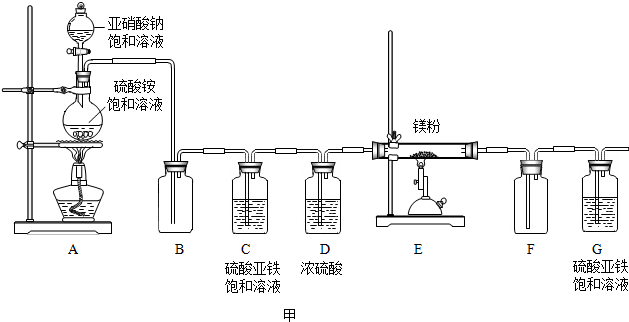
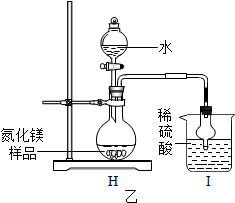
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com