
| 白色粉末的成分 | 形成的原因 |
| 可能是CaCO3 | 石灰水与空气中CO2反应; 化学方程式为:Ca(OH)2+CO2=CaCO3↓+H2O |
| 可能是Ca(OH)2 | 暑假气温较高,溶质的溶解度降低或溶剂蒸发,石灰水中的溶质结晶析出 |
| OH- | Cl- | CO32- | NO3- | |
| Ca2+ | 微 | 溶 | 不 | 溶 |
| 实验步骤 | 可能观察到的现象 | 结论 |
| 取上述试管中的上层清液,滴加1~2无色酚酞试液 | 酚酞试液变红色 | 白色粉末中有Ca(OH)2 |
| 往上述试管中的残留的固体中加入稀盐酸 | 有气泡产生 | 白色粉末中有(选填“有”或“无”)CaCO3 |
| 由上述实验可知白色粉末的成分是:Ca(OH)2和CaCO3的混合物. | ||
分析 石灰水在空气中能与二氧化碳反应生成碳酸钙,同时氢氧化钙是微溶于水的,并随温度的升高溶解度降低,而可能结晶析出,因此在猜想白色固体的成分时要全面考虑,可能的其中的一种,也可能是二者的混合物.由此设计实验,在验证具体含有什么物质时要通过明显的现象得出结论,可以据此答题.
解答 解:(1)若白色固体为碳酸钙,则应该是氢氧化钙和二氧化碳反应而生成的,故可以写出该反应的化学方程式;当然该白色固体也可能是水的蒸发而导致氢氧化钙析出;如果氢氧化钙是部分被反应成了碳酸钙,那么此时白色固体也可能是碳酸钙和氢氧化钙的混合物;故:
| 白色粉末的成分 | 形成原因 |
| Ca(OH)2+CO2=CaCO3↓+H2O | |
| Ca(OH)2 |
| 实验步骤 | 可能观察到的现象 | 结论 |
| 酚酞试液变红色 | 白色粉末中有Ca(OH)2 | |
| 有气泡产生 | 有 | |
| CaCO3和Ca(OH)2的混合物 | ||
| 实验步骤 | 可能观察到的现象 | 结论 |
| 酚酞试液变红色 | 白色粉末中有Ca(OH)2 | |
| 无气泡产生 | 无 | |
| Ca(OH)2 | ||
| 实验步骤 | 可能观察到的现象 | 结论 |
| 酚酞试液不变色 | 白色粉末中无Ca(OH)2 | |
| 有气泡产生 | 有 | |
| CaCO3 | ||
| 白色粉末的成分 | 形成的原因 |
| Ca(OH)2+CO2=CaCO3↓+H2O | |
| Ca(OH)2 |
| 实验步骤 | 可能的现象 | 结论 |
| 酚酞试液变红色 | 白色粉末中有Ca(OH)2 | |
| 有气泡产生 | 有 | |
| Ca(OH)2和CaCO3的混合物 | ||
点评 主要考查了氢氧化钙的变质,及氢氧化钙和碳酸钠的化学性质,培养学生分析问题、解决问题的能力.


 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案科目:初中化学 来源: 题型:解答题
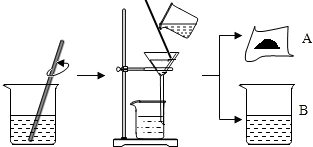 据有关资料介绍:氢氧化钙和与纯碱(Na2CO3)在水中作用,可以得到氢氧化钠.某化学课外小组的同学们为了制取氢氧化钠,将一定量的氢氧化钙粉末放入烧杯中,再向其中加入一定量的纯碱溶液,充分反应冷却后过滤、洗涤得到固体A和溶液B,操作步骤如图所示.请你与小组同学共同完成以下探究:[温馨提示:氢氧化钙微溶于水]
据有关资料介绍:氢氧化钙和与纯碱(Na2CO3)在水中作用,可以得到氢氧化钠.某化学课外小组的同学们为了制取氢氧化钠,将一定量的氢氧化钙粉末放入烧杯中,再向其中加入一定量的纯碱溶液,充分反应冷却后过滤、洗涤得到固体A和溶液B,操作步骤如图所示.请你与小组同学共同完成以下探究:[温馨提示:氢氧化钙微溶于水]| 实验内容 | 实验现象 | 实验结论 |
| 甲同学:取少量固体于试管中,向其中加入稀盐酸. | 有气泡产生 | 自己的猜想正确 |
| 乙同学:取少量固体于试管中,加水充分溶解、过滤,向滤液中滴加酚酞试液 | 溶液由无色变为红色 | 自己的猜想正确 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 酸和碱能发生中和反应,生成盐和水.
酸和碱能发生中和反应,生成盐和水.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 气体发生装置可能相同 | B. | 气体收集方法可能相同 | ||
| C. | 反应的基本类型相同 | D. | 反应条件可能相同 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
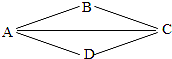 金属和酸、碱、盐的化学性质是初中化学的核心知识,如图,A、B、C、D分别表示上述四类物质中常见的一种,A、B、C、D之间的连线表示它们彼此之间能够发生化学反应,其中A与B能够发生中和反应,D是目前世界上产量最多的金属.请回答:
金属和酸、碱、盐的化学性质是初中化学的核心知识,如图,A、B、C、D分别表示上述四类物质中常见的一种,A、B、C、D之间的连线表示它们彼此之间能够发生化学反应,其中A与B能够发生中和反应,D是目前世界上产量最多的金属.请回答:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | K2Cr2O7中Cr元素的化合价为+6价 | |
| B. | NH4NO3中氮、氢、氧原子个数比为2:4:3 | |
| C. | C2H4与C4H8中碳元素和氢元素的质量比相同 | |
| D. | 已知20℃时,NaCl的溶解度为36g,则该温度下氯化钠饱和溶液的质量分数为36% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com