
| 反应前 | 反应后 | ||
| 实验数据 | 烧杯和稀盐酸的质量 | 石灰石样品的质量 | 烧杯和其中混合物的质量 |
| 153.4克 | 10g | 160.1g | |
分析 碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,反应前后的质量差即为反应生成二氧化碳的质量,根据二氧化碳质量可以计算碳酸钙的质量,进一步可以计算该石灰石样品中碳酸钙的质量分数.
解答 解:(1)根据质量守恒定律,反应生成CO2的质量为:153.4g+10g-160.1g=3.3g,
故填:3.3g.
(2)设碳酸钙的质量为x,
CaCO3+2HCl═CaCl2+H2O+CO2↑,
100 44
x 3.3g
$\frac{100}{x}$=$\frac{44}{3.3g}$,
x=7.5g,
该石灰石样品中碳酸钙的质量分数为:$\frac{7.5g}{10g}$×100%=75%,
答:该石灰石样品中碳酸钙的质量分数为75%.
点评 差量法在计算中的应用很广泛,解答的关键是要分析出物质的质量差与要求的未知数之间的关系,再根据具体的数据求解.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 为了研究质量守恒定律,设计了如图“白磷燃烧前后质量测定”的实验,请分析有关问题:
为了研究质量守恒定律,设计了如图“白磷燃烧前后质量测定”的实验,请分析有关问题:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氢气在空气中燃烧时,产生淡蓝色火焰 | |
| B. | 细铁丝在空气中剧烈燃烧,火星四射,生成黑色固体 | |
| C. | 用力振荡盛有水和植物油的试管,得到澄清透明的液体 | |
| D. | 把银片插入硫酸铜溶液中,一段时间后取出,银片表面有一层红色物质 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
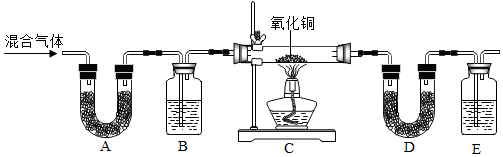
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
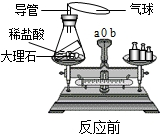 化学是一门实验科学,观察或动手,会启迪你的智慧.以下几个实验是老师,或是你亲自做过的,请你按要求填写合理解释或现象.
化学是一门实验科学,观察或动手,会启迪你的智慧.以下几个实验是老师,或是你亲自做过的,请你按要求填写合理解释或现象.查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
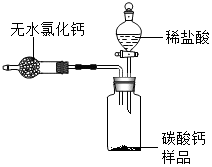 为测定某市售CaCO3药品中CaCO3的质量分数(杂质为SiO2,与稀HCl不反应),某同学的方法是:将样品与稀盐酸反应,测定反应后生成的CO2质量,再根据CO2的质量求出样品中CaCO3的质量,从而计算出样品中CaCO3的质量分数.为测定生成CO2的质量,他设计了如图的实验方案(已知;无水氯化钙是常见的干燥剂):
为测定某市售CaCO3药品中CaCO3的质量分数(杂质为SiO2,与稀HCl不反应),某同学的方法是:将样品与稀盐酸反应,测定反应后生成的CO2质量,再根据CO2的质量求出样品中CaCO3的质量,从而计算出样品中CaCO3的质量分数.为测定生成CO2的质量,他设计了如图的实验方案(已知;无水氯化钙是常见的干燥剂):查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 尘土飞扬--分子在不断运动 | |
| B. | 酿制美酒--分子本身发生改变 | |
| C. | 水银温度计热胀冷缩--分子间间隔改变 | |
| D. | 水结成冰--分子体积变大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com