

分析 根据物质的性质、饱和碳酸氢钠的作用、过氧化氢与二氧化碳反应也与水反应,干燥剂能防止空气中的水蒸气进入解答即可.
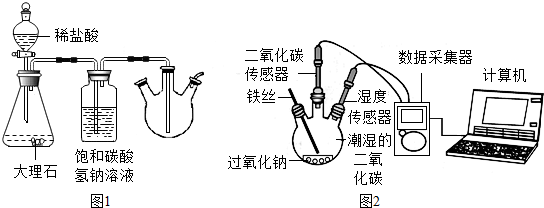
解答 解:实验一:(1)大理石的主要成分是碳酸钙,能与盐酸反应生成氯化钙、水和二氧化碳,饱和碳酸氢钠溶液能吸收挥发出来的氯化氢气体,故填:CaCO3+2HCl=CaCl2+CO2↑+H2O;吸收氯化氢;
(3)根据图示可以看出,过氧化钠在湿度较大的条件下与二氧化碳能反应,故填:过氧化钠在湿度较大的条件下与二氧化碳能反应;
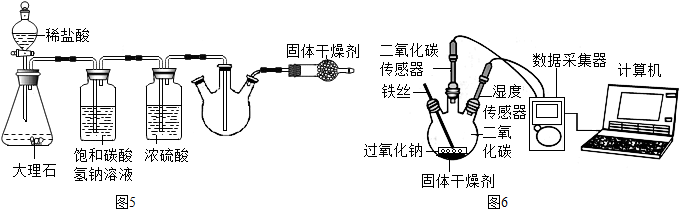
实验二:(1)干燥管中的碱石灰能防止空气中的水蒸气进入三口瓶,防止对二氧化碳的湿度造成影响,故填:防止空气中的水蒸气进入三口瓶;
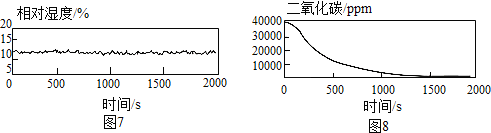
【结论与反思】(1)根据图7和图8可看出,在湿度较小的条件下,过氧化氢也能与二氧化碳反应,故猜想2正确,故填:2;
(2)图3中湿度在减小,说明水分减少,说明过氧化氢能与水发生反应,故填:过氧化钠与水能反应.
点评 本题考查的是物质性质的实验探究,完成此题,可以依据题干提供的信息结合物质的性质进行.


科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
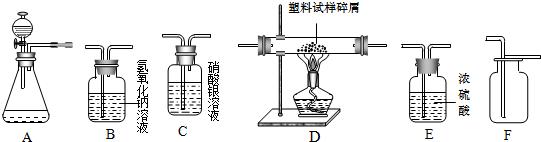
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 | 结论 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
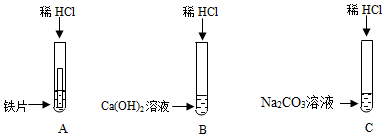
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量滤液于试管中,向其中滴加无色酚酞试液 | 无色酚酞试液变红 | 猜想成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验步骤 | 设计这一步骤的目的 |
| 1.将配制的氢氧化钠溶液加热 | |
| 2.在加热后的溶液中滴入酚酞,并在上方滴一些植物油 |
| 实验方法 | 可能观察到的现象和结论 |
查看答案和解析>>
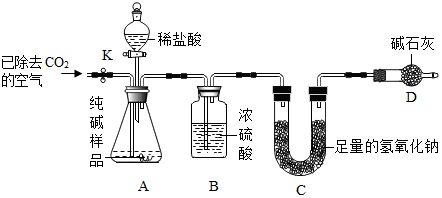
科目:初中化学 来源: 题型:实验探究题
| 实验操作 | 实验现象 | 实验结论 |
| 取一定量纯碱样品配成溶液后,滴加过量的CaCl2溶液. | 产生白色沉淀 | 反应的化学方程式: Na2CO3+CaCl2═CaCO3↓+2NaCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com