【答案】
分析:(1)根据甲酸(HCOOH)与浓硫酸共热到60~80℃可发生脱水型的分解反应的信息回答.
(2)根据反应的放热现象回答.
(3)根据甲酸和浓硫酸密度不同,反应在两液体的界面发生,振动试管可调节两反应物的接触面积回答.
(4)根据用浓硫酸和甲酸的混合液制取CO气体的药品状态和反应条件、用CO还原氧化铜的装置、一氧化碳的毒性、检验二氧化碳的方法回答.
解答:解:(1)甲酸(HCOOH)与浓硫酸共热到60~80℃可发生脱水型的分解反应,即反应物为甲酸,生成物为水和一氧化碳,条件是浓硫酸和加热60~80℃,所以方程式为HCOOH
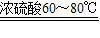
CO↑+H
2O.
(2)甲酸和浓硫酸混合时,可产生大量的热,使反应液温度达到反应所需的温度,所以不需要加热.
(3)甲酸和浓硫酸密度不同,反应在两液体的界面发生,振动试管可可使两反应物相互混合、溶解,调节两反应物的接触面积,从而加快反应速率.
(4)用浓硫酸和甲酸的混合液制取CO是两种液体在常温下反应制气体,一氧化碳有毒,还原氧化铜时要有尾气处理装置,二氧化碳能使澄清的石灰水变浑,检验氧化产物用澄清的石灰水,装置如下图.
故答案为:(1)HCOOH
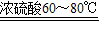
CO↑+H
2O;

(2)甲酸和浓硫酸混合时,可产生大量的热,使反应液温度达到反应所需的温度;
(3)由于甲酸和浓硫酸密度不同所以甲酸在上层,浓硫酸在下层,反应在两液体的界面发生,振动试管可使两反应物相互混合、溶解,增大反应物相互间的接触面而加快反应速率;
(4)实验装置中若选用其它仪器(如酒精灯等)或所用同类仪器超过三件的均不给分.
点评:气体的制取是初中重要的化学实验之一,既是难重点,又是考查热点,理解反应原理,掌握装置的选择依据、气体的检验、验满、收集方法,了解实验步骤和注意事项是解决该类问题的关键.

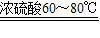 CO↑+H2O.
CO↑+H2O.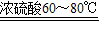 CO↑+H2O;
CO↑+H2O; (2)甲酸和浓硫酸混合时,可产生大量的热,使反应液温度达到反应所需的温度;
(2)甲酸和浓硫酸混合时,可产生大量的热,使反应液温度达到反应所需的温度;

 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案