
【题目】某研究小组对自动充气气球(如图1)进行下探究。
(查阅资料)
①该气球的充气原理是:通过挤破液体包,使液体与白色粉末接触产生二氧 化碳气体,实现气球自动充气。
②氯化钙水溶液呈中性,碳酸钠、碳酸氢钠的水溶液均呈碱性。
③用一定溶质质量分数的 NaHCO3和Na2CO3溶液进行实验,实验现象记录如下:
NaHCO3溶液 | Na2CO3溶液 | |
加入澄清石灰水 | 溶液变浑浊 | 溶液变浑浊 |
加入CaCl2溶液 | 无明显变化 | 溶液变浑浊 |
加热溶液至沸腾,将气体通入澄清石灰水 | 澄清石灰水变浑浊 | 澄清石灰水无明显变化 |
探究1:气体的成分
为检验气体是二氧化碳,可选用______(填试剂名称).
探究2:液体包内溶液的酸碱性
室温时,用 pH试纸测得溶液的 pH 的方法是____;若 测得溶液的 pH=3,则该溶液呈___性。
探究 3:白色粉末的成分
(猜想与假设)甲同学认为是碳酸钙;乙同学认为是碳酸钠;丙同学认为是碳酸氢钠;丁同学 认为是碳酸钠和碳酸氢钠的混合物。
(进行实验)
(1)将少量白色粉末放入水中搅拌,观察到______,说明甲同学的猜想不正确。
(2)室温时,分别向盛有碳酸氢钠、碳酸钠和白色粉末样品的锥形瓶中注入等体积、足量的
10%的盐酸(装置如图2),记录如下表:


(解释与结论)
(1)实验Ⅰ的化学方程式为__________。
(2)表中a=_______;V1________V2(填“>”、“<”或“=”)。
(3)上述实验得出的结论及判断依据是__________。
(反思与评价)老师指出还可以采用更简单的方法得出与上述实验(2)相同的结论,实验方案为____。
【答案】澄清石灰水 用玻璃棒蘸取溶液,滴到pH试纸上,再与标准比色卡比较颜色 酸 固体全部溶解 Na2CO3+2HCl=2NaCl+H2O+CO2↑ 0.10 > 白色粉末的成分为碳酸氢钠,因为实验Ⅰ和实验Ⅲ中等量的固体产生了等量的CO2 取待测样品,加水溶解,向其中加入氯化钙溶液,无明显现象,则该白色粉末为碳酸氢钠
【解析】
探究1:二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,所以为检验气体是二氧化碳,可选用氢氧化钙溶液;
探究2:测待测溶液pH的方法:用干净的玻璃棒蘸取待测溶液并滴在pH试纸的一端上,显色后把试纸显示的颜色与标准比色卡对照,读出相同颜色的pH值;溶液的pH小于7,溶液呈酸性,pH越小,酸性越强;溶液的pH大于7,溶液呈碱性,pH越大碱性越强;pH等于7,溶液呈中性。若测得溶液的 pH=3,溶液显酸性;
[进行实验]
(1)将少量白色粉末放入水中搅拌,观察到碳酸钙难溶于水,所以将少量白色粉末放入水中搅拌,固体全部溶解,说明甲同学的猜想不正确;
[解释与结论]
(1) 碳酸氢钠和盐酸反应生成氯化钠、水和二氧化碳,化学方程式为:NaHCO3+HCl=NaCl+H2O+CO2↑;
(2) 碳酸氢钠、碳酸钠的质量都是0.1g,为了形成对比,所以a的质量也是0.1g,每84份质量的碳酸氢钠会生成44份质量的二氧化碳,每106份质量的碳酸钠会生成44份质量的二氧化碳,所以V1>V2;
(3) 根据实验1.3可知,最终得到的二氧化碳体积相等,因此,白色粉末是碳酸氢钠。
[反思与评价]碳酸钠能与氯化钙反应生成碳酸钙沉淀,碳酸氢钠不与氯化钙反应,所以更简单的方法得出与上述实验(2)相同的结论,实验方案为取待测样品,加水溶解,向其中加入氯化钙溶液,无明显现象,则该白色粉末为碳酸氢钠。


科目:初中化学 来源: 题型:
【题目】在木炭还原氧化铜的实验中(如图所示),下列有关说法错误的是( )

A. 实验中澄清石灰水变浑浊是因为生成二氧化碳
B. 实验中发现试管中的黑色固体变红,是因为生成了铜
C. 酒精灯上的网罩的作用:集中火焰,提高温度
D. 该反应的化学方程式为:CuO+C![]() Cu+CO2↑
Cu+CO2↑
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列反应是中和反应的是_____
A 2NaOH+H2SO4=Na2SO4+2H2O B CO2+Ca(OH)2=CaCO3![]() +H2O
+H2O
C 6HCl+Fe2O3=2FeCl3+3H2O D _____.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】向10.7gMg、Al、Zn固体混合物中加入一定量的H2SO4恰好完全反应,反应后的溶液质量增加了10.1g,将反应后溶液蒸发结晶,干燥。获得固体质量为( )
A. 15.5gB. 25.1gC. 39.5gD. 20.3g
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】CaCO3在生产生活中有广泛的用途。
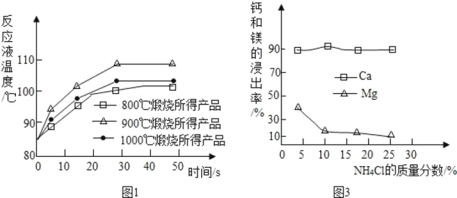
(1)煅烧石灰石可制得活性CaO,反应的化学方程式为_______。为测定不同 煅烧温度对CaO活性的影响,取石灰石样品分为三等分,在同一设备中分别于800℃、900℃和1000℃条件下煅烧,所得固体分别与等质量的水完全反应,测得反应液温度随时 间的变化如图1所示.可知:CaO与水反应会_______热量(填“放出”或“吸收”);上述温度中,______℃煅烧所得 CaO 活性最高.要得出正确结论,煅烧时还需控制的条件是_________。
(2)以电石渣[主要成分为 Ca(OH)2,还含有少量 MgO 等杂质]为原料制备高纯 CaCO3的流程如下:
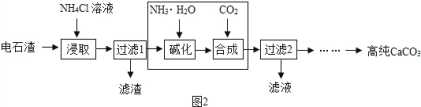
①如图为 NH4Cl 浓度对钙、镁浸出率的响(![]() )。可知:较适宜的 NH4Cl溶液的质量分数为______;浸取时主要反应的化学方程式为_______。
)。可知:较适宜的 NH4Cl溶液的质量分数为______;浸取时主要反应的化学方程式为_______。
②流程中大方框内部分若改用___溶液(填化学式),可一步得到与原流程完全 相同的生成物。
③该流程中可循环利用的物质有________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】水是宝贵的自然资源。请根据下列情况回答问题。
(1)淡水资源有限,我们需要节约用水,图中表示节水标志的是______。

(2)电解水反应前后不变的微粒是______(写微粒符号)。
(3)要除去水样中的色素和异味通常加入活性炭,是利用其具有______性。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为了测定某钢铁样品(主要成分是铁,少量的碳,其他杂质忽略不计)中碳的质量分数,现取一定质量的废钢粉末,向其中逐滴加入稀硫酸,至刚好不再产生气泡,用去稀硫酸100g,过滤、洗涤、干燥,得滤渣0.1g,生成氢气0.3g,求:
(1)所取样品中铁的质量。
(2)该样品中碳的质量分数(精确到0.1%)。
(3)稀硫酸的质量分数。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学兴趣小组用如图装置进行实验,发现镁片完全溶解、石灰水浑浊。
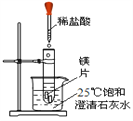
(一)石灰水变浑浊的原因是:
(1)镁和盐酸的反应________(填“吸热”或“放热”)。
(2)_____________________________________________。
(二)甲同学测得反应后试管内溶液pH<7 ,该溶液pH<7的可能原因是:
①MgCl2溶液的pH<7; ②__________________________。
(三)乙同学将反应后试管内溶液冷却,加入镁粉并滴入酚酞,溶液颜色无变化,再加热,发现溶液慢慢浑浊且变红。
【猜想】对实验中“溶液慢慢浑浊且变红”的原因,乙同学提出猜想:
MgCl2+2H2O=Mg(OH)2↓+2HCl,大家都认为此猜想不合理,理由是_________。
【查阅】资料1:Mg(OH)2难溶解于水,升高温度可加大其在水中的溶解度。
资料2:K、Ca、Na、Mg等活泼金属在一定条件下能与水反应,产生碱和气体。
【实验】乙同学重新在滴有酚酞的热水中加入镁粉,观察到液体慢慢变红并浑浊,镁粉表面产生气泡。收集并点燃气体,发现能燃烧。乙同学实验中“溶液慢慢浑浊且变红”的原因请用化学方程式表示:___________________。
(四)丙同学在做实验时,不小心将镁条掉入到碳酸氢钠溶液中,发现产生大量的气泡和白色不溶物。他非常好奇,进行了如下探究。
【提出问题】镁条与碳酸氢钠溶液反应,产生的气体和白色不溶物分别是什么?
【查阅资料】
Mg(OH)2 | MgCO3 | |
溶解性 | 难溶于水 | 微溶于水 |
热稳定性 | 受热易分解,能生成两种氧化物 | 受热易分解,能生成两种氧化物 |
实验探究一:镁条与碳酸氢钠溶液反应产生什么气体呢?
猜想 | 实验方法 | 现象 | 结论 | |
① | 二氧化碳 | 收集气体于集气瓶中,而后将气体通入澄清石灰水中; | 无明显现象 | 猜想①不成立 |
② | 氧气 | 收集气体于集气瓶中,而后将________放入瓶中; | 无明显现象 | 猜想②不成立 |
③ | 氢气 | 第一步,点燃产生的气体; 第二步,在火焰上罩内壁涂有石灰水的烧杯。 | 气体能被点燃; 烧杯内壁无现象; | 猜想______成立 (填序号) |
④ | _____ | |||
⑤ | 甲烷 | |||
实验探究二:
【提出问题】镁条与碳酸氢钠溶液反应,产生的白色不溶物是什么?
【作出猜想】丙同学根据资料分析认为白色不溶物可能是Mg(OH)2和MgCO3中的一种或两种。
【进行实验】
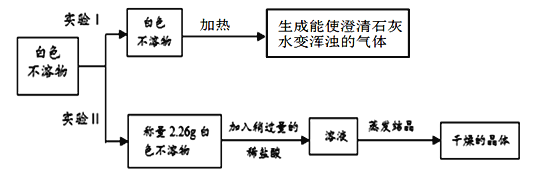
(1)根据实验Ⅰ的现象,写出加热白色不溶物时一定发生的化学反应的方程式__________;
(2)实验Ⅱ中 称量“干燥的晶体”质量为2.85g,由此通过计算确定白色不溶物是成分是_________________。(请你写出计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com