
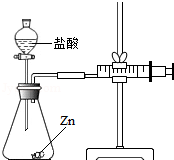
 化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.
化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.| 实验编号 | 选用金属(均取2g) | 盐酸质量分数(均取50mL) | 每分钟产生氢气的体积/mL | |||||
| 1分钟 | 1-2分钟 | 2-3分钟 | 3-4分钟 | 4-5分钟 | 前5分钟共收集气体 | |||
| Ⅰ | 锌片 | 15% | 2.9 | 16.9 | 11.0 | 9.2 | 7.6 | 48.5 |
| Ⅱ | 锌片 | 5% | 1.6 | 8.4 | 5.9 | 4.8 | 3.7 | 24.4 |
分析 【设计探究】金属与酸的反应为置换反应,写出反应的化学方程式;根据现象得出结论;
得出结论:根据金属的活动性顺序,分析金属的活动性与反应的剧烈程度的关系;
实验(2)根据注射器的作用是量取生成气体的体积解答;
得出结论:根据表中信息结合浓度对反应的影响分析解答;
【反思评价】根据表中信反应的剧烈程度与酸的浓度有关,结合反应的过程进行分析;根据控制变量法结合影响反应速率的因素进行设计实验;
【拓展延伸】根据反应前后固体的质量增加求出生成铜的质量即可.
解答 解:【设计探究】由题意知:反应物、生成物,根据质量守恒定律,正确书写化学方程式,铁与盐酸反应的化学方程式为:Fe+2HCl=FeCl2+H2↑;锌与盐酸反应的化学方程式为:Zn+2HCl=ZnCl2+H2↑;放锌片的试管中立即产生大量气泡,放铁片的试管中只产生少量气泡,因此金属活动性强弱为:Zn>Fe;
得出结论:金属与盐酸反应的剧烈程度与金属本身性质有关(金属活动性越强,反应越剧烈);
实验(2)注射器的作用是通过注射器往右移动的体积判断生成氢气的体积;
得出结论:根据表格信息可知,其他条件相同时,盐酸浓度越大,反应越剧烈;
【反思评价】锌与盐酸反应产生气体的速度先加快后变慢,因为锌与盐酸是放热反应,所以开始时温度升高,产生气体速度加快,随着反应的进程,盐酸不断被消耗,浓度降低,产生气体速度变慢.
金属与盐酸反应的剧烈程度可能受固体的表面积、反应物的状态、催化剂的影响;
【拓展延伸】设生成Cu的质量为m,则:
Fe+CuSO4=Cu+FeSO4 质量增加△m
56 64 8
ag m (b-a)g
$\frac{64}{m}=\frac{8}{(b-a)g}$
m=8(b-a)g
故答案为:【设计探究】Fe+2HCl=FeCl2+H2↑、Zn+2HCl=ZnCl2+H2↑;>;
金属与盐酸反应的剧烈程度与金属本身性质有关(金属活动性越强,反应越剧烈);
实验(2)通过注射器往右移动的体积判断生成氢气的体积;
得出结论:其他条件相同时,盐酸浓度越大,反应越剧烈;
【反思评价】由慢到快然后逐渐减慢;锌与稀盐酸反应放热,随着反应的进行,温度升高,所以速度越来越快,一段时间后,盐酸被消耗,盐酸浓度变小,反应速率减慢.温度;
【拓展延伸】8(b-a)g.
点评 本考点主要考查了影响金属与酸发生化学反应速率的因素的探究,还考查了在生产、生活及实验中应注意的问题.从酸的浓度、金属的活动性和金属的状态等不同的角度,设计实验,也考查了学生的实验设计能力.要认真分析,综合把握,问题就会迎刃而解.本考点主要出现在实验题中.


科目:初中化学 来源: 题型:选择题
| A. | 八月桂花飘香,说明分子总是在不断运动 | |
| B. | 水结成冰,是因为温度降低,分子停止运动 | |
| C. | 酒精挥发,说明酒精分子的体积增大 | |
| D. | 保持汞化学性质的微粒是汞分子 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 原子能构成分子,也可以直接构成物质 | |
| B. | 分子在物理变化中不会改变 | |
| C. | 相同原子可能构成不同的分子 | |
| D. | 水是由两个氢原子和一个氧原子构成的 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 将CO2通入CaCl2溶液中,有白色沉淀生成 | |
| B. | 金刚石、石墨和C60都是碳元素的单质 | |
| C. | 在一定条件下CO2能够转变成CO | |
| D. | 将CO2通入紫色石蕊溶液中,可看到溶液变红 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com