
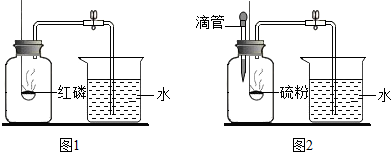
分析 (1)空气成分的测定实验的原理是利用某种物质燃烧消耗空气中某一成分,导致装置内的压强减小,从而使等体积液体倒流进入装置内.液体倒流的直接原因是装置内外的压强差,最根本的原因是物质燃烧对气体的消耗.这就要求生成物不能是气体,而当生成物为气体时,我们就必须想办法让液体能够和生成的气体反应或者溶解.
(2)乙同学实验中生成二氧化硫气体,借助二氧化硫的溶解性当然可以实现目的,但是为了促进溶解进行,或者叫启动反应的发生,我们可以借助更快捷的反应就是氢氧化钠溶液来吸收二氧化硫,这样水就能够更迅速进入装置内去溶解二氧化硫.
(4)对于使用天平来测定,要学会倒推,知道质量就可以根据密度求体积,所以要根据操作去分析实验的思路和原理.
解答 解:(1)空气成分的测定实验的原理是利用某种物质燃烧消耗空气中某一成分,导致装置内的压强减小,从而使等体积液体倒流进入装置内.液体倒流的直接原因是装置内外的压强差,最根本的原因是物质燃烧对气体的消耗.这就要求生成物不能是气体,而当生成物为气体时,我们就必须想办法让液体能够和生成的气体反应或者溶解.
(2)乙同学实验中生成二氧化硫气体,借助二氧化硫的溶解性当然可以实现目的,但是为了促进溶解进行,或者叫启动反应的发生,氢氧化钠溶液来吸收二氧化硫,这样水就能够更迅速进入装置内去溶解二氧化硫.
(4)根据题目中给定的天平和烧瓶体积的信息,可以称量金属在反应前后质量的变化,从而计算消耗的氧气的质量,根据氧气的密度求出氧气的体积,从而求出空气中氧气的含量.则氧含量为:$\frac{N-M}{ρ}÷V$=$\frac{N-M}{Vρ}$;
故答案:
(1)装置内的压强小于外界的气压;
(2)SO2+2NaOH=Na2SO3+H2O;
(4)$\frac{N-M}{Vρ}$.
点评 要在实验改进中学会根据实验的操作来研究实验的思路,例如本题在天平上就要结合题目中提供的操作过程去猜想实验思路.


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 步骤 | 实验操作 | 主要实验现象 | 结论(燃烧产物判断) |
| (1) | 将产物溶于适量水中 | 部分溶解,试管 底部有黑色固体 | 燃烧产物中肯定有C |
| (2) | 取少量(1)所得上层溶液,加入过量的 BaCl2溶液 | 有白色沉淀生成 | 燃烧产物中肯定有Na2CO3 |
| (3) | 取少量(2)所得上层溶液,加入CuSO4(或CuCl2)溶液 | 有蓝色沉淀生成 | 燃烧产物中肯定有Na2O |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 红磷在空气中燃烧后生成五氧化二磷固体 | |
| B. | 肥皂水滴入硬水中,产生较多泡沫,较少浮躁 | |
| C. | 硫在空气中燃烧发出淡蓝色火焰,产生有刺激性气味的气体 | |
| D. | 铁丝在空气中剧烈燃烧,火星四射,生成一种黑色固体 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 白色粉末的成分 | 形成的原因 |
| 可能是CaCO3 | 石灰水与空气中CO2反应; 化学方程式为:Ca(OH)2+CO2=CaCO3↓+H2O |
| 可能是Ca(OH)2 | 暑假气温较高,溶质的溶解度降低或溶剂蒸发,石灰水中的溶质结晶析出 |
| OH- | Cl- | CO32- | NO3- | |
| Ca2+ | 微 | 溶 | 不 | 溶 |
| 实验步骤 | 可能观察到的现象 | 结论 |
| 取上述试管中的上层清液,滴加1~2无色酚酞试液 | ||
| 往上述试管中的残留的固体中加入稀盐酸 | 白色粉末中有(选填“有”或“无”)CaCO3 | |
| 由上述实验可知白色粉末的成分是:Ca(OH)2、CaCO3. | ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com