
下列仪器不能用作反应容器的是( )
A. 量筒 B. 烧杯 C. 试管 D. 集气瓶
A 【解析】A、量筒只能用于量取液体的体积不能用作反应器,正确;B、烧杯可用于作反应器,错误; C、试管可用于加热也可用作反应器,错误;D、集气瓶可作有气体参加反应的反应容器,如铁丝在盛有氧气的集气瓶中燃烧,错误。故选A。科目:初中化学 来源:江苏省扬州市宝应县2018届九年级下学期中考二模考试化学试卷 题型:多选题
如图是a、b、c三物质的溶解度曲线,下列分析不正确的是

A. t2 ℃时a、b、c三种物质的溶解度由大到小的顺序是a>b>c
B. t2 ℃时,将50g a物质放入100g水中充分溶解得到a的饱和溶液(a物质不含结晶水)
C. 将c的饱和溶液变为不饱和溶液,可采用升温的方法
D. 将t2 ℃时a、b、c三种物质的饱和溶液降温至t1 ℃时,所得溶液的溶质质量分数关系是:b>a﹦c
CD 【解析】A、根据溶解度曲线可知,t2℃时,a,b,c三种物质的溶解度由大到小的顺序是a>b>c,正确;B、t2℃时,a的溶解度是50g,即100g水中最多溶解50g的a,将50g a物质放入100g水中充分溶解得到a的饱和溶液,正确;C、c的溶解度随温度的降低而增大,所以将c的饱和溶液变为不饱和溶液,可采用降温的方法,错误;D、a、b的溶解度随温度升高而增大,c的溶解度随温度升高而减小...查看答案和解析>>
科目:初中化学 来源:山东省威海市业考试模拟训练化学试卷 题型:填空题
金属的性质
金属材料是现代生活和工农业生产中应用极为普遍的一类重要物质。请回答下列问题:
(1)请阅读以下信息,并将文中错误的描述标出:_______________ (填写序号)。
①金属都具有银白色金属光泽,②有良好的导电性和导热性。③汞是熔点最高的金属。④合金是由金属与其他金属或非金属熔合而成的,⑤合金是具有金属特性的纯净物,⑥合金一般比组成它的金属硬度大。
(2)大多数金属化学性质活泼,但活泼性有差异。例如,锌、铁、铝这三种金属与氧气或酸液等物质的反应的剧烈程度各有差异。请根据这三种金属的性质完成下面的表格。
反应现象描述 | 对应的金属 (化学式) | 构成该金属的粒子 (粒子符号) | 反应的化学方程式 | 基本反应类型 |
纯氧炉中火星四射 | _____ | _____ | _____ | _____ |
常温即形成致密氧化膜 | _____ | _____ | _____ | _____ |
与稀硫酸反应剧烈程度居中 | _____ | _____ | _____ | _____ |
(3)大多数金属暴露在空气中都易被腐蚀,请举两条防止金属锈蚀的措施:①____________;②____________。
回收重新冶炼是保护金属资源的一条有效途径。请写出用一氧化碳在高温条件下还原锈蚀钢铁(主要成分是Fe2O3)的化学方程式:__________________。
但有时我们也会利用锈蚀为生活服务,请写出下列金属的应用原理:
① 食品袋中的铁粉 ②
食品袋中的铁粉 ② 暖贴中的铁粉 ③
暖贴中的铁粉 ③ 暖气片上涂的铝粉
暖气片上涂的铝粉
①___________________ ;②________ ;③________________ 。
(4)从金属的原子结构看,金属易与其它物质发生反应的根本原因是________________。
①③⑤ Fe Fe 3Fe +2O2 Fe3O4 化合 Al Al 4Al+3O2 == 2Al2O3 化合 Zn Zn Zn+H2SO4=ZnSO4+H2↑ 置换 涂覆保护层 制成合金 Fe2O3+3CO2Fe+3CO2 铁粉吸收氧气和水分,延缓食物变质 铁粉与氧气反应放出热量 铝粉氧化后形成致密氧化膜防止内部金属生锈 金属原子最外层电子数少于4个,在化学反应中易失去电子 【解析】(1)①...查看答案和解析>>
科目:初中化学 来源:江苏省南京市玄武区2018届九年级中考第二次调研化学试卷 题型:流程题
空气、水都是宝贵的资源。
(1)自然界中的水都不是纯水,净水时,需加入明矾的目的是_____。 在生活中常采用_____的方法降低水的硬度。
(2)利用空气、水制取硝酸的一种流程如下图所示。
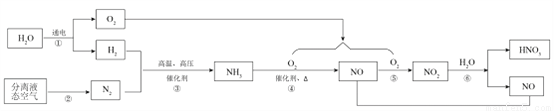
(Ⅰ)步骤①中发生反应的化学方程式为_____。
(Ⅱ)从微观角度解释 NO 和 NO2 化学性质不同的原因_____。
(Ⅲ)实验室制取氧气的化学方程式是______任写一个)。
(3)下列保护空气措施合理的是_____(填标号)。
A. 工厂通过加高烟囱直接排放废气 B. 使用清洁能源
C. 提倡步行、骑自行车等“低碳”出行方式 D. 推广使用乙醇汽油代替普通汽油
吸附杂质,加速沉降 煮沸 2H2O2H2↑+ O2↑ 构成物质的分子不同 2KMnO4K2MnO4+MnO2+O2↑(或2KClO32KCl+3O2↑、2H2O22H2O+O2↑) BCD 【解析】(1)净水时,需加入明矾的目的是吸附杂质,加速沉降;在生活中常采用煮沸的方法降低水的硬度;(2)(Ⅰ)步骤①中发生反应的化学方程式为:2H2O2H2↑+ O2↑;(Ⅱ)由NO 和 NO2 的化学式...查看答案和解析>>
科目:初中化学 来源:江苏省南京市玄武区2018届九年级中考第二次调研化学试卷 题型:单选题
科技人员成功研制出一种新型催化剂,可将二氧化碳转化成液体燃料,反应的微观示意 图如下图,有关该反应的说法正确的是( )

A. 该反应属于化合反应 B. 反应前碳元素的化合价为+2 价
C. 生成物的化学式可用 C2H2O 表示 D. 参加反应的两物质的质量比为 1:1
A 【解析】A.由图可知,该反应是多变一的反应,故该反应属于化合反应,正确;B.反应前碳元素的化合价为+4价,故错误;C.生成物的化学式可用CH2O2表示,故错误;D.参加反应的两物质的质量比为44:2=22:1,故错误。本题选A。查看答案和解析>>
科目:初中化学 来源:北京市朝阳区2018届九年级综合练习(二)化学试卷 题型:科学探究题
小明发现生物老师将一勺白色粉末加入鱼缸后,水中有气泡产生,奄奄一息的鱼很快就活蹦乱跳,于是对这种“白色粉末”产生兴趣,与小刚一起进行了相关探究。
(1)实验准备
①查阅资料:白色粉末的主要成分是过碳酸钠(Na2CO4),常温下与水反应生成氧气。
②用一定溶质质量分数的NaOH和Na2CO3两种溶液进行如下实验。
NaOH溶液 | Na2CO3溶液 | |
滴加酚酞溶液 | 溶液变红色 | 溶液变红色 |
加入稀盐酸 | 无明显现象 | 现象Ⅰ |
加入澄清石灰水 | 无明显现象 | 现象Ⅱ |
加入 1%的CaCl2溶液 | 溶液变浑浊 | 溶液变浑浊 |
加入 0.1%的CaCl2溶液 | 无明显现象 | 溶液变浑浊 |
表中的现象Ⅰ为_____________,现象Ⅱ对应的化学反应方程式为_____________。
(2)实验过程
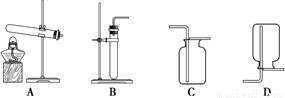
实验1:检验气体
小明用白色粉末和水反应制取并收集产生的气体时,应选用的装置是_____(填序号)。 经检验该气体是氧气。
实验2:检验反应后溶液中的溶质成分
(猜想假设)小明猜想:Na2CO3 小刚猜想:Na2CO3和NaOH
(进行实验)小明取实验1反应后的溶液于试管中,滴加1%的CaCl2溶液,观察到有白色沉淀生成,认为自己的猜想正确。
(表达交流)①小刚对小明的实验方案提出质疑,他的理由是_________________。
②为了证明小明的猜想是否正确,你的实验方案是________________。
(3)反思拓展
根据上述探究可知,保存该白色粉末时应注意___________。
有气泡产生 Na2CO3 + Ca(OH)2 === 2NaOH + CaCO3↓ BC NaOH溶液、Na2CO3溶液中滴加1%的CaCl2溶液均有白色沉淀产生,无法证明溶液中只有Na2CO3 取实验1反应后的溶液于试管中,加入过量0.1%的CaCl2溶液,过滤,向滤液中滴加无色酚酞溶液,若溶液无明显变化,则不含NaOH,若溶液变红,则含有NaOH。 防潮或密封保存 【解析】(1)②Na2...查看答案和解析>>
科目:初中化学 来源:北京市朝阳区2018届九年级综合练习(二)化学试卷 题型:填空题
物质王国举行一场趣味篮球赛。某队由Fe、CO2、H2SO4、Ca(OH)2、CuSO4 5名“队员”组成,比赛中,场上“队员”位置及传球路线如图所示。(图中“——”表示两端物质能发生化学反应)

(1)C位置“队员”所代表的物质是_______。
(2)写出反应②的化学方程式_____________。
Ca(OH)2 Fe+H2SO4=== FeSO4+H2↑ 【解析】CuSO4可与Fe反应,Fe可与H2SO4反应,H2SO4可与Ca(OH)2反应,Ca(OH)2可与CO2反应。(1)C位置“队员”所代表的物质是Ca(OH)2。(2)反应②的化学方程式是:Fe+H2SO4=== FeSO4+H2↑查看答案和解析>>
科目:初中化学 来源:北京市朝阳区2018届九年级综合练习(二)化学试卷 题型:单选题
下列物质的性质,属于化学性质的是
A. 可燃性 B. 颜色 C. 密度 D. 沸点
A 【解析】A. 可燃性属于化学性质,符合题意;B. 颜色属于物理性质,不符合题意;C. 密度属于物理性质,不符合题意;D. 沸点属于物理性质,不符合题意。故选A。查看答案和解析>>
科目:初中化学 来源:江苏省淮安市2018届九年级下学期模拟测试(一)化学试卷 题型:计算题
将20gNaCl和Na2SO4的固体混合物,加入400g BaCl2溶液恰好完全反应。过滤、洗涤、干燥固体沉淀物,称得质量为23.3g。(已知:Na2SO4+BaCl2=2NaCl+BaSO4↓)
计算:(1)原混合物含有NaCl的质量。
(2)所用400g BaCl2溶液的溶质质量分数。
(1)5.8g (2)5.2% 【解析】设;原混合物中硫酸钠的质量为x,氯化钡溶液中溶质的质量为y Na2SO4+BaCl2=2NaCl+BaSO4↓ 142 208 233 x y 23.3g =解得x=14.2g,y=20.8g故原样品中氯化钠的质量为20g-14.2g=5.8g; 故BaCl2溶液的溶质质量分数为=5.2%;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com