
【题目】水在生产生活中起着重要的作用。
①氢气燃烧是人们认识水组成的开始,化学方程式是___________________________。
电解水也可以证明水的组成化学方程式是________________________________
②自来水生产消毒过程中通入________,它与水反应生成盐酸和次氯酸(HClO),次氯酸中氯元素的化合价为_______。
③水在化学实验中的作用不可小觑。
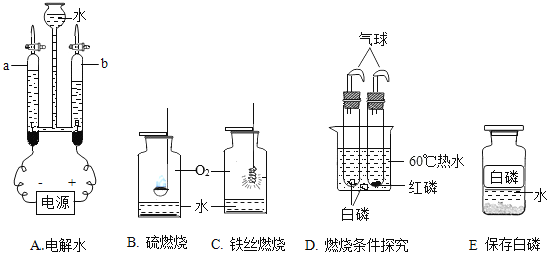
I.A中a、b管中气体的体积比约____________________,
II.B中燃烧的主要现象是_______________________________;
III.C中反应的化学方程式是_________________________,反应类型属于___________;
IV.D可以探究可燃物燃烧的条件是_______________________________;
V.上述实验中,水用来隔绝空气的是______________(填字母序号)。
【答案】2H2 + O2![]() 2H2O 2H2O
2H2O 2H2O![]() 2H2↑ + O2↑ Cl2(液氯/氯气) +1 1:2 明亮的蓝紫色火焰,生成刺激性气味的气体 3Fe+2O2
2H2↑ + O2↑ Cl2(液氯/氯气) +1 1:2 明亮的蓝紫色火焰,生成刺激性气味的气体 3Fe+2O2![]() Fe3O4 化合反应 与氧气(空气)接触、温度达到着火点 DE
Fe3O4 化合反应 与氧气(空气)接触、温度达到着火点 DE
【解析】
氢气和氧气点燃生成水,电解水生成氢气和氧气,硫在氧气中燃烧生成二氧化硫,铁丝在氧气中点燃生成四氧化三铁。
①氢气燃烧生成水,化学方程式是2H2 + O2![]() 2H2O,电解水生成氢气和氧气,化学方程式是2H2O
2H2O,电解水生成氢气和氧气,化学方程式是2H2O![]() 2H2↑ + O2↑。
2H2↑ + O2↑。
②自来水生产消毒过程中通入Cl2(液氯/氯气),次氯酸的化学式为HClO,次氯酸中氧元素的化合价为-2价,氢元素的化合价为+1价,设氯元素的化合价为x,则![]() ,x=+1,故氯元素的化合价为+1价。
,x=+1,故氯元素的化合价为+1价。
③I.电解水正极产生氧气,负极产生氢气,则a管生成氧气,b管生成氢气,故A中a、b管中气体的体积比约1:2。
II.硫在氧气中燃烧生成二氧化硫,B中燃烧的主要现象是产生明亮的蓝紫色火焰,生成刺激性气味的气体。
III.铁丝在氧气中点燃生成四氧化三铁,C中反应的化学方程式是3Fe+2O2![]() Fe3O4
Fe3O4
,反应符合多变一,属于化合反应。
IV.燃烧条件:物质是可燃物、达到可燃物的着火点、有氧气参与,D中有空气参与,红磷和白磷在60℃的温度下实验,故可以探究可燃物燃烧的条件是与氧气(空气)接触、温度达到着火点。
V.A中水是反应物,B中水用来吸收二氧化硫,C中水吸收热量,防止高温生成的熔融物炸裂瓶底,D中水用来隔绝空气,E中水用来隔绝空气,故水用来隔绝空气的是DE。


科目:初中化学 来源: 题型:
【题目】结合如图所示实验装置回答问题。
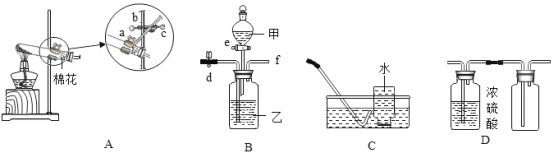
(1)装置AC组合制取氧气
①装置A中反应化学方程式为_____________,欲调整该装置中试管的倾斜角度,可调节旋钮________________(填”a”或”b”或”c”)。
②可用装置C收集氧气的原因是________。开始收集氧气的最佳时机是________________.
③实验结束撤装置时,发现试管破裂,可能的错误操作是________________(写一点)。
(2)装置B有多种功能
①装置B和D组合可制取干燥的气体:关闭止水夹d,打开活塞e,则该气体可能是________(填标号)。
X ![]() Y
Y ![]() Z
Z ![]()
②装置B可用来分离![]() 和
和![]() ,若试剂乙为氢氧化钠溶液,关闭活塞c,打开止水夹d,在导管口f处逸出的气体是________;接着关闭止水夹d,打开活塞e,滴加试剂甲,若甲为稀硫酸,又可收集到另一种气体,则该反应的化学方程式为______________
,若试剂乙为氢氧化钠溶液,关闭活塞c,打开止水夹d,在导管口f处逸出的气体是________;接着关闭止水夹d,打开活塞e,滴加试剂甲,若甲为稀硫酸,又可收集到另一种气体,则该反应的化学方程式为______________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】金属与生活息息相关,认识金属的性质对我们至关重要,认真阅读,回答问题。
材料一:镓(Ga)是灰蓝色或银白色的金属,熔点很低,沸点很高。其化学性质与铝相似,能与氧气在加热时反应。金属镓广泛应用于半导体材料,光电子工业和微波通讯工业等领域。镓的原子结构示意图如图所示。
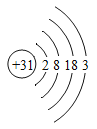
(1)镓的物理性质有_________________________。
(2)写出镓与氧气反应的化学方程式___________________________。
材料二:金属活动顺序在工农业生产和科学研究中有重要应用。现有铜、银、锌三种金属,某小组同学为了探究这三种金属的活动性,设计了以下实验:

(3)试管A中反应的化学方程式是_________________________,由实验A、B、C可推断出Ag、Zn、Cu三种金属的活动性由强到弱的顺序为_____________________。
(4)向C完全反应后的试管里加入一定质量的锌粒(如D试管)。D试管中一定会发生的反应是的化学方程式是________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】图1为KNO3的溶解度曲线,a、b在溶解度曲线上。图2为向50g水中溶解一定量KNO3固体的操作图示。
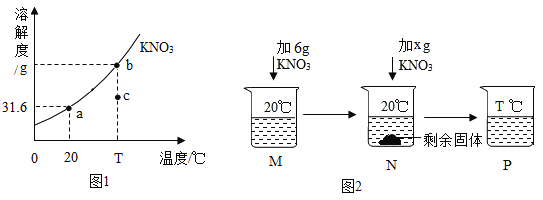
①KNO3的溶解度随温度的升高而_________(填“增大”或“减小”)。
②a 点表示的意义是 20℃时,在__________中最多溶解硝酸钾 31.6 克;
a 点对应的溶液的溶质质量分数是__________(只列计算式)。
③欲使 KNO3溶液的状态从b点转化为c点,可采取的措施是_________。
④关于图 2 中烧杯内的物质,说法正确的有__________(填编号)。
A M 和 N 的溶液中,溶质质量相等
B 当 x=9.8g 时,N中恰好没有固体剩余
C M、N、P 中,M、P 的溶液一定是不饱和溶液
D M 的溶液中溶质质量分数一定比 P 的溶液中溶质质量分数小
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图为甲、乙(均不含结晶水)两种固体物质的溶解度曲线。
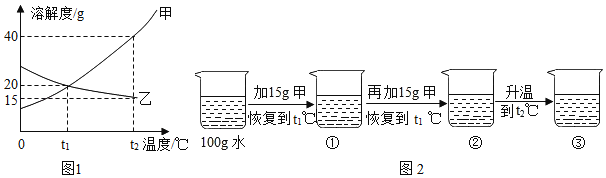
(I)溶解度随温度升高而增大的物质是_____(填“甲”或“乙”);t1℃时,甲的溶解度_____(填“大于”“小于”或“等于”)乙的溶解度。
(II)某同学在t1℃时开始进行如图2实验,得到相应的溶液①~③.在溶液①~③中属于饱和溶液的是_____(填序号)、溶质质量分数最大的是_____(填序号)。
(III)t2℃时280g甲的饱和溶液中所含甲的质量为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图为四种粒子的结构示意图,根据图示回答有关问题:
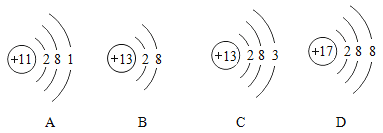
(1)写出其中属于阴离子的离子符号________。
(2)元素M形成的氧化物为M2O3,则M的原子结构示意图可能是________(填字母序号)。
(3)铝制品形成致密保护膜的化学方程式是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学是一门以实验为基础的科学,下面是初中化学中几个重要的对比实验。
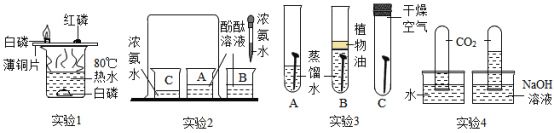
①“实验1”中,观察到铜片上的白磷燃烧而水中的白磷不燃烧,可得出可燃物燃烧的一个条件为_____;
②“实验2”中,观察到A.烧杯中酚酞变红,可验证分子具有___的性质,B烧杯的作用是为了证明___,从而起到对比的作用。
③“实验3”中,只有A中铁钉生锈了。对比铁钉不同的现象,可推知铁生锈的条件是与____同时接触;
④“实验4”中,对比两支试管内液面高低的不同,可说明氢氧化钠能与二氧化碳发生反应,该反应的化学方程式_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下表是NaCl、KNO3在不同温度时的溶解度,根据数据回答。
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度 | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
(g/100g水) | KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 |
①氯化钠的溶解度受温度变化的影响_____(填“很大”或“很小”)。
②50℃时,KNO3的溶解度_____(填“<”、“>”或“=”)NaCl的溶解度;向烧杯中加入100g水和49.0gKNO3固体配成50℃的溶液,再冷却到20℃,烧杯中析出固体的质量为_____g。
③KNO3中混有少量的NaCl,提纯的方法是_____(填“降温结晶”或“蒸发结晶”)。
④要比较NaCl和KNO3在水中的溶解性强弱,测定的数据可以是:相同温度下,等质量的溶质完全溶解达到饱和时所需水的质量;或_____。
⑤如图是有关硝酸钾溶液的实验操作及变化情况,说法正确的是_____(填编号)。
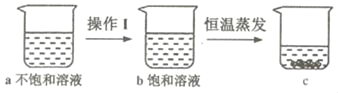
A 操作I一定是降温
B a与b的溶剂质量可能相等
C a与c的溶质质量一定相等
D b与c的溶质质量分数一定相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com