解:
(1)根据某物质由氢元素和氧元素组成,其分子中原子个数比为1:1,推知该物质为2H
2O
2;依据书写化学方程式的步骤:写配注等,该物质发生分解反应的化学方程式为:2H
2O
2
2H
2O+O
2↑;
故答案为:2H
2O
2
2H
2O+O
2↑;
(2)根据元素化合价,利用十字交叉法,写出化学式:
A.氧化钠表示为 Na
2O,故A错误;
B.氧化铝表示为 Al
2O
3,故B错误;
C.硫酸钠表示为 Na
2SO
4,故C错误;
D.氯化铁表示为 FeCl
3;故D错误; 故答案为:A,B,C,D;
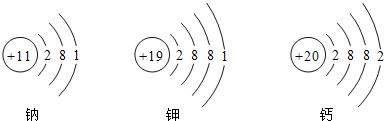
(3)根据金属活动顺序表可知钠、钾、钙三种金属活动性由强至弱的顺序是:钾、钙、钠;
根据原子结构示意图可知影响三种金属活动性强弱的因素有:B电子层数;D.最外层电子数;
故答案为:钾、钙、钠(或K、Ca、Na); BD;
(4)根据元素质量守恒定律,推知反应2NaHCO
3
Na
2CO
3+X+Y↑中 X和Y的化学式分别为:H
2O、CO
2;
故答案为:H
2O、CO
2.
分析:(1)根据某物质由氢元素和氧元素组成,其分子中原子个数比为1:1,推知该物质为2H
2O
2;依据书写化学方程式的步骤:写配注等,写出方程式即可;
(2)根据元素化合价,利用十字交叉法,写出化学式进行解答;
(3)根据金属活动顺序表,和3种金属的原子结构示意图,进行解答;
(4)根据元素质量守恒定律进行分析及本题.
点评:本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

 Na2CO3+X+Y↑(X和Y均为氧化物)推测,X和Y的化学式分别为________.
Na2CO3+X+Y↑(X和Y均为氧化物)推测,X和Y的化学式分别为________. 2H2O+O2↑;
2H2O+O2↑; 2H2O+O2↑;
2H2O+O2↑; Na2CO3+X+Y↑中 X和Y的化学式分别为:H2O、CO2;
Na2CO3+X+Y↑中 X和Y的化学式分别为:H2O、CO2;

 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案 --氢原子
--氢原子 --碳原子
--碳原子 --氧原子
--氧原子




 ”、“
”、“ ”、“
”、“ ”分别表示A、B、C三种物质的分子,下图表示某化学反应前后反应物与生成物分子及其数目的变化.该化学方程式中A、B、C前的化学计量数之比为
”分别表示A、B、C三种物质的分子,下图表示某化学反应前后反应物与生成物分子及其数目的变化.该化学方程式中A、B、C前的化学计量数之比为

 表示A元素的原子,
表示A元素的原子, 表示B元素的原子.某反应前后的物质微观示意图如下.
表示B元素的原子.某反应前后的物质微观示意图如下.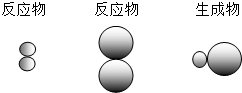
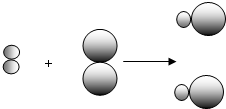 和
和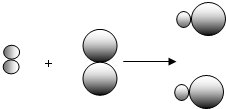 中的
中的 属于同种元素,这是因为这些原子含有相同的
属于同种元素,这是因为这些原子含有相同的 表示甲元素的原子,
表示甲元素的原子, 表示乙元素的原子.某反应前后的物质微观示意图如下.
表示乙元素的原子.某反应前后的物质微观示意图如下.


 和
和 中的
中的 属于同种元素,这是因为这些原子含有相同的
属于同种元素,这是因为这些原子含有相同的




