
| A. | 用一氧化碳冶炼金属:CO+O2$\frac{\underline{\;燃烧\;}}{\;}$CO2 | |
| B. | 用适量盐酸清除铁锈:Fe2O3+6HCl═2FeCl2+3H2O | |
| C. | 用红磷燃烧测定空气中氧气的含量:4P+5O2↑$\frac{\underline{\;点燃\;}}{\;}$2P2O5 | |
| D. | 高温燃烧石灰石制取生石灰:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ |
分析 根据化学方程式判断正误的方法需考虑:应用的原理是否正确;化学式书写是否正确;是否配平;反应条件是否正确;↑和↓的标注是否正确.
解答 解:A、用一氧化碳冶炼金属,利用的是一氧化碳的还原性,而不是可燃性,故选项错误.
B、铁锈的主要成分是氧化铁,与盐酸反应生成氯化铁和水,正确的化学方程式是:Fe2O3+6HCl═2FeCl3+3H2O.
C、该化学方程式反应物中氧气是气体,后面不需要标注↑,正确的化学方程式应为:4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5.
D、该化学方程式书写完全正确.
故选:D.
点评 本题难度不大,在解此类题时,首先分析应用的原理是否正确,然后再根据方程式的书写规则进行判断;化学方程式正误判断方法是:先看化学式是否正确,再看配平,再看反应条件,再看气体和沉淀,最后短线改成等号.


 教学练新同步练习系列答案
教学练新同步练习系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 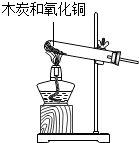 黑色粉末变成红色,说明木炭具有可燃性 | |
| B. | 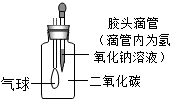 气球变大,说明二氧化碳与氢氧化钠发生了反应 | |
| C. | 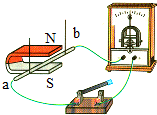 让导线在磁场中竖直上下运动时产生了感应电流 | |
| D. |  用弹簧测力计水平拉动木块做匀速直线运动,此时摩擦力的大小为1.2牛 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
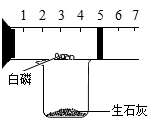 某同学用如图装置粗略地测定空气中氧气的体积分数,图中烧杯中盛放的生石灰(即氧化钙)与水反应生成氢氧化钙,同时放出大量热.烧杯上方玻璃管(预先固定好)中部有一可左右滑动的活塞,活塞左端管内封有空气,活塞右端的玻璃管口跟外界空气连通.白磷很易燃且燃烧产物与红磷燃烧的产物相同,实验开始前活塞处在刻度5cm处.
某同学用如图装置粗略地测定空气中氧气的体积分数,图中烧杯中盛放的生石灰(即氧化钙)与水反应生成氢氧化钙,同时放出大量热.烧杯上方玻璃管(预先固定好)中部有一可左右滑动的活塞,活塞左端管内封有空气,活塞右端的玻璃管口跟外界空气连通.白磷很易燃且燃烧产物与红磷燃烧的产物相同,实验开始前活塞处在刻度5cm处.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
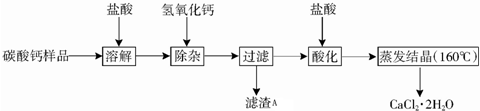
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Ca(OH)2 |
| 开始沉淀时的pH | 2.3 | 4.0 | 7.8 |
| 完全沉淀时的pH | 3.7 | 5.2 | 10.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com