

| Fe(OH)3 | Al(OH)3 | Mg(OH)2 | |
| 开始沉淀时的pH | 1.5 | 3.3 | 10.4 |
| 沉淀完全时的pH | 3.2 | 5.2 | 12.4 |
分析 (1)根据过滤操作可以将固体和液体分离,以及过滤操作需要的主要仪器进行分析;
(2)根据二氧化硅不会与盐酸反应,氧化铁、氧化镁、氧化铝会与盐酸反应生成氯化铁、氯化镁、氯化铝进行分析;
(3)根据氢氧化钠和氯化铁生成的氢氧化铁沉淀会先溶于盐酸中进行分析;
(4)根据氢氧化钠和氯化铝反应生成偏铝酸钠、氯化钠和水,氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠进行分析;
(5)根据氢氧化铁在高温的条件下生成氧化铁和水进行分析;
(6)根据氯化铝、氯化镁和氢氧化钠反应都会生成氯化钠,溶液C中含有氯化钠和偏铝酸钠进行分析;
Ⅲ.根据铁元素守恒进行计算.
解答 解:(1)过滤操作可以将固体和液体分离,过滤操作需要的主要仪器有烧杯、漏斗和玻璃棒;
(2)二氧化硅不会与盐酸反应,氧化铁、氧化镁、氧化铝会与盐酸反应生成氯化铁、氯化镁、氯化铝,所以所加稀盐酸必须过量的原因是:使硫酸渣完全溶解;
(3)氢氧化钠和氯化铁生成的氢氧化铁沉淀会先溶于盐酸中,所以向溶液A中加入试剂M调节pH到7的过程中,沉淀的颜色会经历“红褐色变淡,再变深的过程”的过程,出现该现象的原因是:氢氧化钠会与氯化铁反应生成氢氧化铁沉淀,氢氧化铁沉淀会溶于酸,盐酸消耗完后,氢氧化铁沉淀的沉淀量会逐渐增多,颜色变深;
(4)氢氧化钠和氯化铝反应生成偏铝酸钠、氯化钠和水,氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,化学方程式为:AlCl3+4NaOH=NaAlO2+2H2O+3NaCl,MgCl2+2NaOH=Mg(OH)2↓+2NaCl;
(5)氢氧化铁在高温的条件下生成氧化铁和水,化学方程式为:2Fe(OH)3$\frac{\underline{\;高温\;}}{\;}$Fe2O3+3H2O;
(6)氯化铝、氯化镁和氢氧化钠反应都会生成氯化钠,溶液C中含有氯化钠和偏铝酸钠,所以不可能得到纯净的NaAlO2固体,理由是:溶液C中含有反应生成的氯化钠;
Ⅲ.通过分析可知,铁元素在反应前后质量不变,所以生铁的质量为:$\frac{1000t×37.75%}{1-4%}$=393.2t.
故答案为:(1)漏斗;
(2)使硫酸渣完全溶解;
(3)氢氧化钠会与氯化铁反应生成氢氧化铁沉淀,氢氧化铁沉淀会溶于酸,盐酸消耗完后,氢氧化铁沉淀的沉淀量会逐渐增多,颜色变深;
(4)AlCl3+4NaOH=NaAlO2+2H2O+3NaCl,MgCl2+2NaOH=Mg(OH)2↓+2NaCl;
(5)2Fe(OH)3$\frac{\underline{\;高温\;}}{\;}$Fe2O3+3H2O;
(6)溶液C中含有反应生成的氯化钠;
Ⅲ.393.2t.
点评 在解此类题时,首先分析题中考查的问题,然后结合学过的知识和题中所给的资料进行分析解答.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用锌与稀盐酸制氢气:2Zn+2HCl═2ZnCl+H2↑ | |
| B. | 用红磷燃烧测定空气中氧气含量:S+O2 $\frac{\underline{\;点燃\;}}{\;}$SO2 | |
| C. | 用一氧化碳作燃料:CO+O2 $\frac{\underline{\;点燃\;}}{\;}$CO2 | |
| D. | 高温煅烧石灰石制取二氧化碳:CaCO3 $\frac{\underline{\;高温\;}}{\;}$ CaO+CO2↑ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
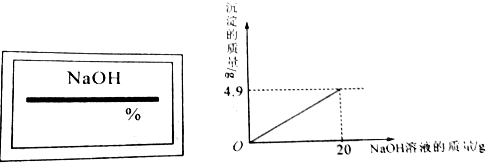
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验操作 | 实验现象 | 实验结论 |
| Ⅰ.取少量黑色产物加入到装有足量FeCl3溶液的烧杯中,充分反应后过滤,对过滤所得固体用蒸馏水洗涤. | 黑色固体部分溶解 | 猜想2和4都不成立 |
| Ⅱ.取少量黑色产物加入到装有足量稀盐酸的烧杯中,充分反应后,向溶液中滴加KSCN溶液 | 黑色固体全部溶解,溶液不变红色 | |
| Ⅲ.另取少量黑色产物装入玻璃管中,通入CO,一段时间后加热,并将反应后的气体通入装有一定量的澄清石灰水的烧杯中. | 澄清石灰水变浑浊 | 猜想1不成立 猜想3成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 碳粉和二氧化锰(加双氧水) | B. | 二氧化碳和氮气(用燃着的木条) | ||
| C. | 蒸馏水与食盐水(过滤) | D. | 硬水和澄清石灰水(加肥皂水) |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
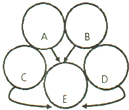 A、B是初中常见的酸和碱,且反应产生白色沉淀,C、D、E是三种常见的氧化物,C通常情况下为气体,如图用圆表示这五种物质,用两圆相切表示两种物质可以发生化学反应,用“→”表示一种物质能转化为另一种物质.
A、B是初中常见的酸和碱,且反应产生白色沉淀,C、D、E是三种常见的氧化物,C通常情况下为气体,如图用圆表示这五种物质,用两圆相切表示两种物质可以发生化学反应,用“→”表示一种物质能转化为另一种物质.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com