

分析 (1)碳酸钠和稀硫酸反应生成硫酸钠、水和二氧化碳;
(2)实验装置不同,优缺点不同;
(3)干燥管在反应前后的质量差即为反应生成二氧化碳的质量,根据二氧化碳质量和反应的化学方程式可以计算碳酸钠质量,进一步可以计算该产品中碳酸钠的质量分数.
解答 解:(1)图甲中,碳酸钠和稀硫酸反应生成硫酸钠、水和二氧化碳,发生的化学方程式为:Na2CO3+H2SO4═Na2SO4+H2O+CO2↑.
故填:Na2CO3+H2SO4═Na2SO4+H2O+CO2↑.
(2)图乙装置的优点是:二氧化碳中的水蒸气能被C装置中的浓硫酸吸收,能够防止水蒸气对实验的干扰,实验结束后打开d,慢慢鼓入空气10min,能使反应生成的二氧化碳全部被碱石灰吸收.
故填:能够防止水蒸气对实验的干扰;能使反应生成的二氧化碳全部被碱石灰吸收.
(3)设碳酸钠质量为x,
反应生成二氧化碳质量为:162.4g-158.0g=4.4g,
Na2CO3+H2SO4═Na2SO4+H2O+CO2↑,
106 44
x 4.4g
$\frac{106}{x}$=$\frac{44}{4.4g}$,
x=10.6g,
该产品中碳酸钠的质量分数为:$\frac{10.6g}{11.0g}$×100%=96.4%,
故填:96.4%.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 实验室利用下列装置制取并收集O2(试管中的棉花根据反应的需要选择是否添加).
实验室利用下列装置制取并收集O2(试管中的棉花根据反应的需要选择是否添加).查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 高铁酸钾是一种氧化物 | |
| B. | 用高铁酸钾处理后的水中含大量高铁酸根离子(FeO42-) | |
| C. | 高铁酸钾中铁的化合价是+3价 | |
| D. | 用高铁酸钾净化过的水,pH升高 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 保存三甲基一氯硅烷时应密封防水 | |
| B. | 三甲基一氯硅烷水溶液pH一定小于7 | |
| C. | 108.5g三甲基一氯硅中含碳元素12g | |
| D. | 扑灭三甲基一氯硅引发的着火,不能用水灭火 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
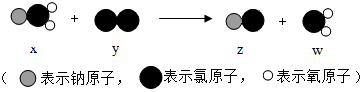
| A. | x、y、z、w均为化合物 | B. | 该反应属于复分解反应 | ||
| C. | 氯元素在物质y中显-1价 | D. | 化学反应前后原子的种类不变 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com