

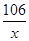 =
= x=31.8g
x=31.8g =
=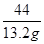 y=35.1g
y=35.1g 所得溶液的总质量为 674.5g-200g-50g×13%=468g
所得溶液的总质量为 674.5g-200g-50g×13%=468g = 10%
= 10% =
=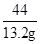
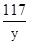 =
=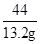
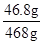 ×100%=10%
×100%=10%

 口算能手系列答案
口算能手系列答案科目:初中化学 来源:不详 题型:计算题
| | 第一次 | 第二次 | 第三次 |
| 氧气的质量(g) | 3 | 4 | 6 |
| 二氧化硫的质量(g) | 6 | | |
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前质量/g | 20 | m | 20 | 20 |
| 反应后质量/g | 2 | 待测 | 32 | 26 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题

查看答案和解析>>
科目:初中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:初中化学 来源:不详 题型:填空题
 (2)取10g此盐酸于烧杯中,逐滴滴加溶质质量分数为
(2)取10g此盐酸于烧杯中,逐滴滴加溶质质量分数为| 加入氢氧化钠 的体积/mL | 0 | 1.0 | 8.0 | 9.5 | 10.5 | 12.0 | 16.5 |
| 烧杯中溶液pH | 1.0 | 1.3 | 2.0 | 3.9 | 9.9 | 11.9 | 12.8 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题

查看答案和解析>>
科目:初中化学 来源:不详 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com