课外化学兴趣小组的同学利用某化工厂的废碱液(主要成分为Na2CO3、还含有少量NaCl,其它杂质不计)和石灰乳(氢氧化钙的悬浊液)为原料制备烧碱,并对所得的烧碱粗产品的成分进行分析和测定.
(1)将废碱液加热蒸发浓缩,形成较浓的溶液,冷却后与石灰乳混合,发生反应的化学方程式为______.将反应后的混合物过滤,得到的滤液进行蒸发结晶,制得NaOH粗产品.
(2)取适量粗产品溶于水,加入CaCl2溶液出现白色浑浊,该粗产品中一定还含有______.因而该小组同学通过以上的实验分析,确定该粗产品中含有三种物质.
(3)该小组同学又另取20.0g粗产品,逐滴加入20%的盐酸至恰好完全反应时,消耗盐酸的质量为73g,放出CO2 4.4g(不考虑二氧化碳气体的溶解).求原粗产品中NaOH的质量分数.(写出计算过程)
【答案】
分析:(1)根据题干的信息可以知道反应为碳酸钠和熟石灰的反应,可以写出化学方程式.
(2)本题中的物质够和氯化钙反应生成沉淀只有碳酸钠,可以作出判断.
(3)分析反应,可以根据二氧化碳的质量来进行求算.
解答:解:(1)根据题干的信息可以知道反应为碳酸钠和熟石灰的反应,可以写出化学方程式.
(2)根据题给物质,向粗产品的溶液中加入氯化钙产生了沉淀,则可以判断在粗产品中还含有碳酸钠,
(3)分析该题中所发生的反应为碳酸钠和盐酸的反应,根据所生成二氧化碳的质量可以解答该题.
故答案为:(1)Na
2CO
3+Ca(OH)
2=CaCO
3↓+2NaOH
(2)Na
2CO
3(3)解:设与粗产品中碳酸钠反应的氯化氢质量为x
Na
2CO
3+2HCl=2NaCl+H
2O+CO
2↑
73 44
x 4.4g
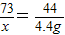
解得:x=7.3g
与粗产品中氢氧化钠反应的氯化氢的质量为:73g×20%-7.3g=7.3g
设粗产品中含氢氧化钠的质量为y
NaOH+HCl=NaCl+H
2O
40 36.5
y 7.3g
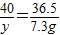
解得:y=8g
粗产品中含氢氧化钠的质量分数为:
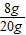
×100%=40.0%
答:粗产品中含氢氧化钠的质量分数为40.0%.
点评:熟练掌握碳酸钠、氢氧化钙的化学性质,知道烧碱的工业制法,能够根据题给的信息进行计算.记住化学方程式:Na
2CO
3+Ca(OH)
2=CaCO
3↓+2NaOH.

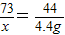
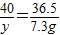
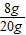 ×100%=40.0%
×100%=40.0%

 名校课堂系列答案
名校课堂系列答案 某校化学课外兴趣小组的同学在研究性学习课上展示了一套如下图所示实验装置(假设每步化学反应都完全,氧化铁样品中的杂质不参加反应).查阅资料:草酸在浓硫酸存在时加热发生如下反应:H2C2O4
某校化学课外兴趣小组的同学在研究性学习课上展示了一套如下图所示实验装置(假设每步化学反应都完全,氧化铁样品中的杂质不参加反应).查阅资料:草酸在浓硫酸存在时加热发生如下反应:H2C2O4
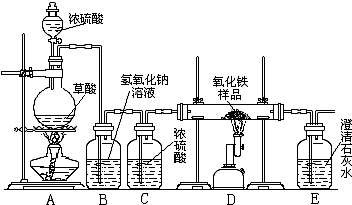
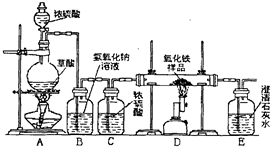 某校化学课外兴趣小组的同学在研究性学习课展示了一套如图所示的实验装置(假设每步化学反应都完全,氧化铁样品中的杂质不反应).查阅资料:草酸在浓硫酸存在时加热发生如下反应:
某校化学课外兴趣小组的同学在研究性学习课展示了一套如图所示的实验装置(假设每步化学反应都完全,氧化铁样品中的杂质不反应).查阅资料:草酸在浓硫酸存在时加热发生如下反应: CO↑+CO2↑+H2O
CO↑+CO2↑+H2O