
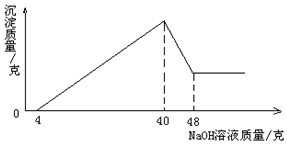
 准确称取5克铝土矿(含Al2O3,Fe2O3,SiO2)样品,放入盛有50克某质量分数的硫酸溶液的烧杯中,充分反应后过滤,再向滤液中加入20%的氢氧化钠溶液,产生沉淀的质量与所加入的氢氧化钠溶液质量的关系如图所示.
准确称取5克铝土矿(含Al2O3,Fe2O3,SiO2)样品,放入盛有50克某质量分数的硫酸溶液的烧杯中,充分反应后过滤,再向滤液中加入20%的氢氧化钠溶液,产生沉淀的质量与所加入的氢氧化钠溶液质量的关系如图所示.分析 稀硫酸和氧化铝反应生成硫酸铝和水,和氧化铁反应生成硫酸铁和水,和氢氧化钠反应生成硫酸钠和水;
氢氧化铝和氢氧化钠反应生成偏铝酸钠和水,根据反应的化学方程式及其提供的数据可以进行相关方面的计算和判断.
解答 解:(1)Al2O3、Fe2O3与H2SO4反应生成 Al2(SO4)3、Fe2(SO4)3,从图分析,过滤掉SiO2滤液有H2SO4、Al2(SO4)3、Fe2(SO4)3,
加入氢氧化钠全部反应需用NaOH溶液量为40g,转化为沉淀Fe(OH)3、Al(OH)3,硫酸与它们的反应转化为与NaOH反应;
设硫酸溶液的溶质是质量分数x,
2NaOH+H2SO4=Na2SO4+2H2O,
80 98
40g×20% x×50g
$\frac{80}{40g×20%}$=$\frac{98}{x×50g}$,
x=19.6%,
(2)从图分析,后来沉淀减少是由于Al(OH)3+NaOH=NaAlO2+2H2O,用于该反应的NaOH溶液8g,
设铝元素质量是y,
由Al2O3+3H2SO4═Al2(SO4)3+3H2O,Al2(SO4)3+6NaOH=2Al(OH)3↓+3Na2SO4,Al(OH)3+NaOH=NaAlO2+2H2O,可知
2Al~Al2O3~2NaOH,
设铝元素质量为y,
2Al~Al2O3~2NaOH,
54 80
y (48g-40g)×20%
$\frac{54}{y}$=$\frac{80}{(48g-40g)×20%}$,
y=1.08g,
铝土矿中含铝的质量分数为:$\frac{1.08g}{5g}$×100%=21.6%,
答:硫酸溶液的溶质质量分数为19.6%,铝土矿中含铝的质量分数为21.6%.
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.


科目:初中化学 来源: 题型:选择题
| A. | 合金是由两种或两种以上金属熔合而成的具有金属特性的物质 | |
| B. | 在日常生活中,大量使用的常常不是纯金属,而是它们的合金 | |
| C. | “真金不怕火炼”说明黄金的硬度非常大 | |
| D. | 合金的熔点一般比它的成分金属熔点高 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
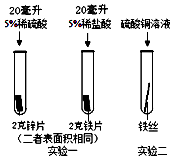 小明为探究锌、铁、铜三种金属的活动性顺序,设计了如图所示的两个实验:
小明为探究锌、铁、铜三种金属的活动性顺序,设计了如图所示的两个实验:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 0℃ | 20℃ | 40℃ | 60℃ | |
| NaHCO3 | 6.9 | 9.6 | 12.7 | 16.4 |
| NaCl | 35.7 | 35.8 | 36.6 | 37.3 |
| NH4Cl | 29.4 | 37.2 | 45.8 | 55.2 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 原子质量不同 | B. | 元素符号不同 | ||
| C. | 原子核外的电子数不同 | D. | 原子核内的质子数不同 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com