
分析 (1)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答.
(2)首先根据反应原理找出反应物、生成物、反应条件,根据化学方程式的书写方法、步骤进行书写即可.
(3)由质量守恒定律:反应前后,原子种类、数目均不变,据此由反应的化学方程式推断横线上生成物的化学式.
(4)根据在金属活动性顺序中,排在氢前面的金属,能够和稀盐酸、稀硫酸发生置换反应,生成氢气和相应的盐;排在金属活动性顺序前面的金属,能够把排在后面的金属从它的盐溶液中置换出来进行分析.
解答 解:(1)氧化铝中铝元素和氧元素的质量比为(27×2):(16×3)=9:8.
(2)工业上用一氧化碳还原氧化铁炼铁,主要是利用CO的还原性,在高温下和氧化铁反应生成铁和二氧化碳,反应的化学方程式为Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
(3)由质量守恒定律:反应前后,原子种类、数目均不变,由反应的化学方程式,反应前铜、氧、硫原子个数分别为6、2、1,反应后的生成物中铜、氧、硫原子个数分别为6、0、0,根据反应前后原子种类、数目不变,则每个横线上生成物分子由1个硫原子和2个氧原子构成,则该物质的化学式为SO2.
(4)向稀硫酸、硫酸亚铁和硫酸铜的混合液中加入一定量的锌时,反应顺序为:先和硫酸铜反应,再和稀硫酸反应,最后和硫酸亚铁反应;向滤渣中加入盐酸,有气泡产生,说明滤渣中至少含有锌和铁中的一种,即当锌消耗完硫酸铜和稀硫酸后,还有剩余,再和硫酸亚铁反应一定能生成铁,所以滤渣中一定含有的物质是铜和铁,滤液中一定含有的物质是硫酸锌,硫酸亚铁是否含有,无法确定.
故答案为:Cu、Fe,ZnSO4.
故答案为:
(1)9:8.(2)Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.(3)SO2.(4)Cu、Fe,ZnSO4.
点评 本题难度不大,掌握化学式的有关计算、化学方程式的书写方法、利用化学反应前后原子守恒来确定物质的化学式是正确解答本题的关键.


 53随堂测系列答案
53随堂测系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
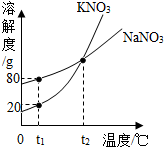 如图表示是KNO3和NaNO3的溶解度曲线.下列说法正确的是( )
如图表示是KNO3和NaNO3的溶解度曲线.下列说法正确的是( )| A. | t1℃时,两种溶液中溶质质量分数一定不相等 | |
| B. | t1℃时,在50g水里加入15g KNO3固体,充分溶解,得到60g溶液 | |
| C. | t1℃时,硝酸钾、硝酸钠两物质饱和溶液升温到t2℃后,溶质质量分数相等 | |
| D. | 两种饱和溶液从t2℃降温到t1℃时,析出晶体:硝酸钾一定多于硝酸钠 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 溶液都是由一种溶质和一种溶剂组成的 | |
| B. | 溶液里各部分的性质是相同的 | |
| C. | 只要条件不变,糖水里的糖不会分离出来 | |
| D. | 通常不指明溶剂的溶液是水溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| AgNO3 | Ba(NO3)2 | AgCl | BaCl2 | |
| H2O | 170g | 92.0g | 1.50×10-4g | 33.3g |
| NH3 | 86.0g | 97.2g | 0.80g | 0.00g |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用酚酞鉴别食盐水和稀醋酸 | |
| B. | 用胆矾检验汽油中是否掺水 | |
| C. | 用燃着的木条检验某气体是否是二氧化碳 | |
| D. | 用氯化钡溶液鉴别稀盐酸和稀硫酸 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com