
 |
���ϱ� |
| Ħ������SiO2��20%�� CaCO3�������� ������NaHCO3��15%�� ���ݼ���K12���������� ��ʪ�������͵ȣ�60%�� ���������������� �������㾫��ˮ�� |
| ʵ���� | 1 | 2 | 3 |
| ʵ��ǰ��g�� | 2.00 | 2.00 | 2.00 |
| ʵ���g�� | 0.43 | 0.44 | 0.45 |
| 0.44g |
| 2.0g |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| +4 |
| C |
| +4 |
| C |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
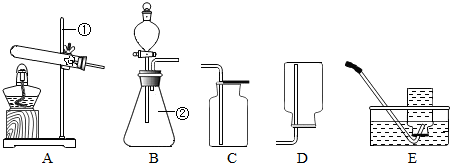
| ||
| ||
| ��� | ʵ������ | ʵ������ | ʵ����� |
| 1 | ȡ��Ӧ�����ʣ����0.2g����5mL 6%��H2O2��Һ�� | ���ҷ�Ӧ���ų����������������������� | �������е�MnO2���ֽ�H2O2 |
| 2 | ȡ0.2gMnO2����5mL a a ��H2O2������������H2O2��Һ�� |
ƽ�ȷ�Ӧ������������������������ | MnO2���ֽ�H2O2 |
| 3 | ȡ��Ӧ�����ʣ����1.0g��������ˮ�У�����ܽ⣬���� | ������ȫ�ܽ⣬��ֽ����ɫ��������� | b b |
| ||
| ||
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com