
【题目】下列化学实验现象中正确的是
A.干冰在空气中升华周围出现白雾
B.红磷燃烧时会产生浓厚的烟雾
C.打开浓盐酸的瓶塞,能看到大量的白烟
D.打开浓硫酸的瓶塞,能看到大量的白雾
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:初中化学 来源: 题型:
【题目】 相同质量的CO和CO2,则CO和CO2所含的氧元素质量比为_________,若CO和CO2所含的氧元素质量相等,则CO和CO2质量比为_________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列物质的性质与所对应的用途没有直接关系的是
A.氧气的密度比空气略大﹣﹣用于急救病人
B.稀有气体的性质稳定﹣﹣作保护气
C.石墨能导电﹣﹣可作电极
D.干冰升华吸热﹣﹣用于人工降雨
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】将下列各组物质分别加入到水中,能得到无色透明溶液的是
A.FeCl3、KOH、NaCl B.K2SO4、BaCl2、HCl
C.CuSO4、HCl、KCl D.Na2CO3、KCl、Na2SO4
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(14分)研究性学习小组甲对教材实验结论“葡萄糖与新制氢氧化铜反应生成的红色沉淀是氧化亚铜(Cu2O),提出质疑,他们认为红色沉淀不一定全是氧化亚铜。为了确定红色沉淀的成分,开展了如下研究:
提出猜想:红色沉淀可能是①Cu2O。②Cu2O和Cu
查阅资料:①氧化亚铜能与酸反应,得到+2价的铜盐和单质铜;
②在空气中灼烧氧化亚铜生成氧化铜;
研究性学习小组甲设计出三种方案来验证猜想
方案1:取该红色沉淀加入稀盐酸中,观察溶液是否变蓝;
方案2:取该红色沉淀溶于足量的稀硫酸中,观察是否有残渣;
方案3:称取红色沉淀a g,在空气中充分灼烧至完全变黑,并在干燥器里冷却,再称重,反复多次直到固体恒重,称得质量为b g,比较a,b关系;
(1)葡萄糖的化学式为 ,属于 (填”有机物”或”无机物”),检验葡萄糖用的新制氢氧化铜由硫酸铜溶液与氢氧化钠溶液反应生成,反应的化学方程式为
(2)根据查阅资料,写出氧化亚铜与稀硫酸的反应方程式 。
研究性学习小组甲设计出三种方案你认为合理的方案是 。
研究性学习小组乙设计新的探究方案探究红色沉淀成份,装置如下图所示。
已知①2NH3+3Cu2O![]() N2+6Cu+3H2O
N2+6Cu+3H2O
②浓氨水与固体CaO接触,会逸出大量氨气, 碱石灰是氧化钙和氢氧化钠的混合物可吸收水和二氧化碳
方案如下(1)连好装置,检查装置气密性
(2)准确称取28.8克的红色沉淀于玻璃管中
(3)先A处反应,通一段时间氨气后称量D质量为108.3克,
(4)加热装置C
(5)待D中恒重为111.9克时,停止加热,继续通氨气直到装置C完全冷却.
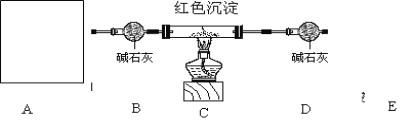
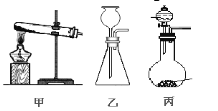
(3)A处为用浓氨水与固体CaO接触,以产生稳定持续的氨气,则A处的发生装置应选 (填”甲”,”乙”或”丙”),,
(4)B中碱石灰的作用是________________,加热前先通氨气的目的除了消除掉原来空气的的二氧化碳和水蒸汽对实验结果影响,还具有一个作用为 .
停止加热,继续通氨气除了让生成的铜充分冷却,还有的一个作用为 。
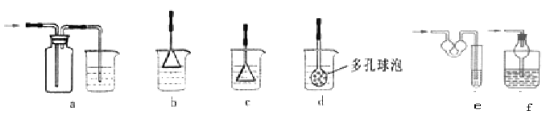
(5)为防止未反应的氨气扩散到空气中,E处可以连接的装置为 (液体均为稀硫酸,从下列选项中选择)
(6)红色沉淀的成份为 (通过计算说明共2分)
(7)有同学认为利用此实验装置还可以测定水中氢.氧元素的质量比,不过还需要测出一个数据,你认为要测出的数据为 (从下列选项中选择),
A.实验所消耗的氨气质量
B.B中干燥管中增加的质量
C.完全反应后玻璃管中固体质量
(8)下列情况会使测定水中氢、氧元素的质量比偏小的有 (从下列选项中选择)
A.红色沉淀未完全反应 B.红色沉淀未完全干燥
C.实验中缺少B装置 D.实验结束后未等铜完全冷却就拆除装置
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(11分)医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙为原料(含量为97.5%,含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙的主要流程如下:
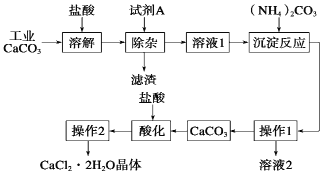
(1)除杂操作时加入试剂A,调节溶液的pH为8.0~8.5,以除去溶液中少量的Al3+、Fe3+。试剂A是Ca(OH)2,还可以选择 。
a.NaOH b.NH3 c.Na2CO3
(2)请指出下列操作的名称:操作1 ;操作2蒸发浓缩、 ;操作1中所用的玻璃仪器有漏斗、玻璃棒、 。
(3)酸化操作是加入过量盐酸,调节溶液的pH为4.0,目的之一是为了将少量的 转化为CaCl2。
(4)写出加入碳酸铵所发生的反应的方程式: +(NH4)2CO3=CaCO3↓+2NH4Cl
写出溶液2的一种用途 。
(5)测定样制得品中Cl-含量的方法是:称1.5g样品,溶解,滴加过量的 AgNO3 溶液,过滤、洗涤、干燥,称得沉淀质量为2.87g,证明沉淀洗净的标准是:取最后一次洗涤的滤液,滴加 试剂,若 现象,则已经洗净。
(6)计算上述样品中CaCl2·2H2O的质量分数为: 。若用上述方法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有: 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组的同学做粗盐(含有难溶性杂质)提纯实验,并用所得的精盐配制50 g 5%的氯化钠溶液。
实验一:如图是同学们做粗盐提纯实验的操作示意图。
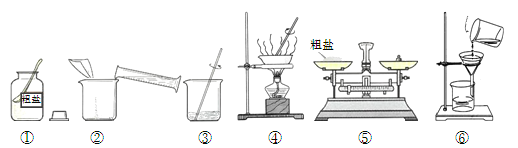
请回答下列问题:
(1)操作③中用玻璃棒搅拌的作用是 。
(2)操作⑥中的错误是 。
(3)粗盐提纯实验的操作顺序为(填操作序号) 、称量精盐并计算产率。
(4)操作④中,当观察到 时,停止加热。
实验二:用提纯得到的精盐配制了50g 5%的氯化钠溶液。经检测,溶质质量分数偏小,其原因可能有 (填序号)。
①氯化钠固体仍然不纯
②量取水时,俯视读数
③称量时砝码端忘垫质量相同的纸片
④装瓶时,有少量溶液洒出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com