12.
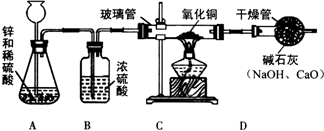
某研究性学习小组的同学用电解水的方法测定水的组成后,提出问题:“测定水的组成还有其他的方法吗?”经过讨论后,得到了肯定的答案,邀请你一起对此展开探究.
【设计方案】甲同学利用氢气还原氧化铜的原理和下图装置及药品进行实验(操作规范).装置A中发生反应的化学方程式为Zn+H
2SO
4═ZnSO
4+H
2↑,洗气瓶B中浓硫酸的作用为吸收水
【实验探究】当玻璃管中固体由黑色转变为红色时,实验测得:①装置C的玻璃管和其中固体的总质量在反应后减少了1.6g;②装置D的干燥管和其中物质的总质量在反应后增加了1.82g,用此数据算得水中H、O元素的质量比为11:80,而由水的化学式算得H、O元素的质量比为1:8.
【分析交流】针对上述结果与理论值有偏差,乙同学认为:该装置存在缺陷,此观点得到了大家的认同,你对此改进的方法是在D装置后面再连接一个干燥管(假设生成的水完全被D中碱石灰吸收,装置内空气中的水蒸气、CO
2忽略不计).小组同学用改进后的装置重新实验得到了正确结果.
【意外发现】丙同学不小心将反应后的少量红色固体a洒落到多量稀硫酸中了,发现除了有红色固体b以外,溶液的颜色由无色变为蓝色.
【提出问题】铜与稀硫酸是不反应的,这里溶液的颜色为什么会变蓝呢?
【查阅资料】①CuO被还原的过程中会有Cu
2O生成,Cu
2O也能被还原为Cu;
②Cu
2O固体是红色的,它与稀硫酸的反应为:Cu
2O+H
2SO
4=CuSO
4+Cu+H
2O.
【得出结论】红色固体a中含有Cu
2O.
【分析交流】红色固体a中含 有Cu
2O是否会影响水组成的测定结果不影响(填“影响”或“不影响”).
【提出猜想】针对红色固体a的成分,小组同学提出猜想①是:Cu
2O和Cu;猜想②是:Cu
2O.
【拓展探究】丁同学利用改进后的装置及药品重新实验,通过测量反应前后固体质量的方法去确定哪种猜想成立,他已称得:①玻璃管的质量;②反应前红色固体a和玻璃管的总质量,完全反应后,你认为他还需要称量反应后红色固体a和玻璃管 的质量.
【教师点拨】称取一定质量的红色固体a与足量的稀硫酸充分反应后,经过滤、洗涤、干燥后再称量红色固体b的质量,也可以确定哪种猜想成立.
【定量分析】小组同学再次实验,他们开始称取质量为3.6g的红色固体a,与足量的稀硫酸完全反应后得到红色固体b为2g.假如3.6g红色固体a都是Cu
2O,则出生成铜的质量1.6(利用Cu
2O+H
2SO
4=CuSO
4+Cu+H
2O.进行计算);然后,通过与实际得到的固体2g进行比较,判断猜想① 成立(填①或②).

 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案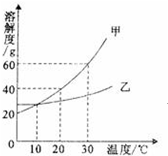 图中表示的是甲、乙两种固体物质的溶解度曲线,下列叙述一定正确的是( )
图中表示的是甲、乙两种固体物质的溶解度曲线,下列叙述一定正确的是( )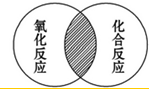 符合图中阴影部分的化学反应的文字表达式的是B
符合图中阴影部分的化学反应的文字表达式的是B
 某研究性学习小组的同学用电解水的方法测定水的组成后,提出问题:“测定水的组成还有其他的方法吗?”经过讨论后,得到了肯定的答案,邀请你一起对此展开探究.
某研究性学习小组的同学用电解水的方法测定水的组成后,提出问题:“测定水的组成还有其他的方法吗?”经过讨论后,得到了肯定的答案,邀请你一起对此展开探究.