
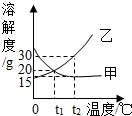
 (1)如图是甲、乙两物质的溶解度曲线,试回答:
(1)如图是甲、乙两物质的溶解度曲线,试回答:分析 根据固体物质的溶解度曲线可以:①查出某物质在一定温度时的溶解度,②比较不同物质在同一温度时的溶解度大小,③判断物质的溶解度随温度变化的变化情况,从而可以确定出给等质量的饱和溶液降温时析出晶体的多少,或判断不饱和溶液和不饱和溶液间的转化方法,提纯物质的方法等.根据金属锈蚀的因素和金属防锈的除锈的方法以及化学方程式的书写方法解答即可.
解答 解:(1)①据图可以看出,t1℃时,甲乙两物质的溶解度交于一点,表示该温度下两种物质的溶解度大小关系相等,故填:相等;
②t1℃时,甲和乙的溶解度都是20g,将20g甲、乙两种固体分别加入至100g水中,都恰好形成饱和溶液,升温到t2℃后,甲的溶解度减小了,仍然是饱和溶液,而乙的溶解度增大了,溶液变成不饱和溶液,由于甲有晶体析出,溶质质量分数变小,而乙的不变,故乙溶液的溶质质量分数较大,故填:甲,乙;
③t2℃时,乙的溶解度是15g,30g乙物质加入到50g水不断搅拌,只能溶解7.5g,充分溶解后得到的溶液质量是50g+7.5g=57.5g,故填:57.5;
(2)铝、铜、铁是生活中常见的金属.
①铝在空气中易被氧气氧化生成致密的氧化铝保护膜,能起到保护的作用,故填:铝在空气中易被氧气氧化生成致密的氧化铝保护膜;
②用铜制电线主要是利用铜具有良好的导电性,故填:导电性;
③铁制品锈蚀,实际上是铁跟空气中的水和氧气发生了化学反应.用稀盐酸除去其表面的铁锈,是盐酸与氧化铁反应生成了氯化铁和水,防止铁制栏杆锈蚀的一种方法是刷油漆,故填:氧气,Fe2O3+6HCl═2FeCl3+3H2O,刷漆.
点评 本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义及根据固体的溶解度曲线解决相关的问题,还考查了金属的有关锈蚀和防锈的知识,要依据已有的金属的性质进行.


 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:初中化学 来源: 题型:选择题
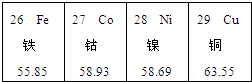
| A. | 镍元素的符号为Ni | |
| B. | 钴元素的相对原子质量是58.93g | |
| C. | 从左到右各元素的原子序数依次增大 | |
| D. | 各元素都属于金属元素 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 盐溶液 | NaCl | Na2CO3 | CaCl2 |
| pH | 等于7 | 大于7 | 等于7 |
| 实验步骤 | 实验现象 | 实验结论 |
| ①取样品溶于水配成溶液,向溶液中滴加CaCl2溶液至过量,充分反应后,静置. | 产生白色沉淀 | 说明久置固体中一定含有Na2CO3(填化学式,下同). |
| ②用玻璃棒蘸取少量①的上层清液滴在pH试纸上,与标准比色卡对照. | pH=11 | 说明久置固体中还一定含有NaOH. |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
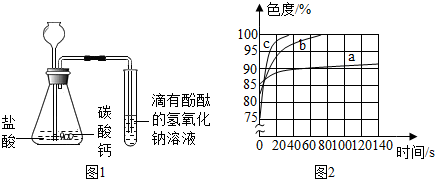
| 实验步骤 | 设计这一步骤的目的 | 实验现象 | 实验结论 |
| ①将NaOH溶液加热煮沸 | ①除去溶液中的氧气 | 溶液变红,过一会儿红色消失 | 甲同学猜想不正确(填“正确”或不正确”) |
| ②向冷却后的溶液中滴人酚酞,并滴一些植物油在其上方 | ②隔绝氧气 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com