
科目:初中化学 来源: 题型:
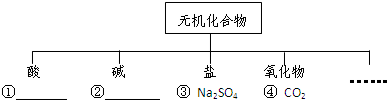

查看答案和解析>>
科目:初中化学 来源: 题型:
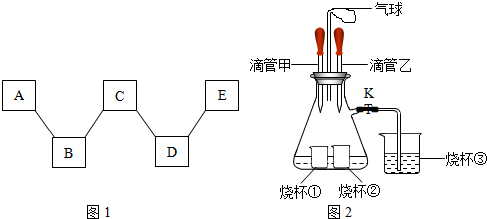
| ||
| ||
| 滴管甲 | 烧杯① | 滴管乙 | 烧杯② | 锥形瓶中溶液 | 烧杯③ | |
| 试剂 | H2O | NaOH或CaO NaOH或CaO |
H2O H2O |
NH4NO3 NH4NO3 |
含酚酞的碱溶液(或含酚酞的NaOH溶液或含酚酞的Ca(OH)2溶液 含酚酞的碱溶液(或含酚酞的NaOH溶液或含酚酞的Ca(OH)2溶液 |
H2SO4或HNO3 H2SO4或HNO3 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
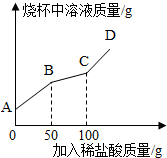 某制碱厂以岩盐水为主要原料生产纯碱(Na2CO3)和其他副产品.
某制碱厂以岩盐水为主要原料生产纯碱(Na2CO3)和其他副产品.| 温度/℃ | 0 | 10 | 20 | 30 | 40 | |
| 溶 解 度 /g |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 |
| Na2SO4 | 4.5 | 9.6 | 20.2 | 40.8 | 48.4 | |
| CaCl2 | 59.5 | 65.0 | 74.5 | 100 | 116 | |
| MgCl2 | 52.9 | 53.8 | 54.8 | 56.0 | 58.0 | |
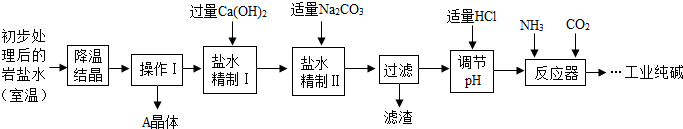
| 工业纯碱标准(Na 2CO3%≥) | ||
| 优等品 | 一等品 | 合格品 |
| 99.2 | 98.8 | 98.0 |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源:黑龙江 题型:问答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com