
| 实验 编号 |
容器Ⅰ | 分液漏斗Ⅰ | 容器Ⅱ | 分液漏斗Ⅱ | 红墨水液面位置 |
| a | 二氧化碳 (充满) |
10mL澄清 石灰水 |
二氧化碳 (充满) |
10mL水 | 左侧液面升高 右侧液面降低 |
| b | 二氧化碳 (充满) |
10mL澄清 石灰水 |
二氧化碳 (充满) |
10mLA溶液 | 左侧液面降低 右侧液面升高 |
| c | 0.65g锌 | 15mL盐酸 | 0.24g镁 | 15mL盐酸 |


科目:初中化学 来源: 题型:阅读理解
| 编号 | 盐酸 | NaOH溶液 | △t/℃ |
| 1 | 3.65% | 2.00% | 3.5 |
| 2 | 3.65% | 4.00% | x |
| 3 | 7.30% | 8.00% | 14 |
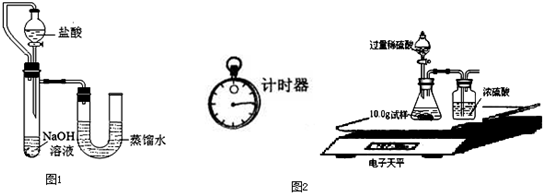
| 称 量 项 目 | 称 量 时 间 | 质量(g) |
| 试样 | 10.00 | |
| 装置+稀硫酸质量 | 241.20 | |
| 装置+稀硫酸质量+试样 | 反应开始后15秒 | 249.20 |
| 装置+稀硫酸质量+试样 | 反应开始后35秒 | 249.00 |
| 装置+稀硫酸质量+试样 | 反应开始后55秒 | 249.00 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
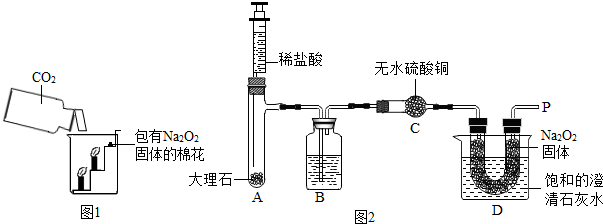
查看答案和解析>>
科目:初中化学 来源:2013-2014学年北京市东城区九年级上学期期末统一测试化学试卷(解析版) 题型:填空题
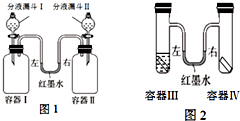
(1)图1所示装置中,容器Ⅰ、II体积相同,U形管内左右两侧液面相平,且装置气密性良好。实验时,打开分液漏斗旋塞,将液体同时滴入容器,滴加完毕后关闭旋塞。实验内容及相关现象如下表所示。

|
实验 编号 |
容器Ⅰ |
分液漏斗Ⅰ |
容器Ⅱ |
分液漏斗Ⅱ |
红墨水液面位置 |
|
a |
二氧化碳 (充满) |
10 mL澄清 石灰水 |
二氧化碳 (充满) |
10 mL水 |
[]左侧液面升高 右侧液面降低 |
|
b |
二氧化碳 (充满) |
10 mL澄清 石灰水 |
二氧化碳 (充满) |
10 mLA溶液 |
左侧液面降低 右侧液面升高 |
|
c |
0.65 g锌 |
15 mL盐酸 |
0.24g镁 |
15 mL盐酸 |
|
实验a中,容器Ⅰ中的现象是________,容器Ⅱ中反应的化学方程式是 。
实验b中,根据红墨水液面位置,推测A溶液可能具有的性质是 。
实验c中,盐酸浓度相同且足量,产生气泡更剧烈的是容器________(填“Ⅰ”或“Ⅱ”);反应结束并恢复至室温后,红墨水液面位置是________。
(2)图2所示装置中,容器III、IV体积相同,其中容器Ⅲ中放有植物油,U形管内左右两端红墨水液面相平。实验时分别向III、IV中加入形状和大小相同的铁片,迅速塞紧橡皮塞并放置一段时间。下列说法错误的是 (填字母序号)。

A.植物油用于隔绝氧气和水
B.两支试管中的铁片均被腐蚀
C.U形管右侧液面降低左侧液面升高
D.U形管左侧液面降低右侧液面升高
查看答案和解析>>
科目:初中化学 来源: 题型:
(1)图1所示装置中,容器Ⅰ、II体积相同,U形管内左右两侧液面相平,且装置气密性良好。实验时,打开分液漏斗旋塞,将液体同时滴入容器,滴加完毕后关闭旋塞。实验内容及相关现象如下表所示。
| 实验 编号 | 容器Ⅰ | 分液漏斗Ⅰ | 容器Ⅱ | 分液漏斗Ⅱ | 红墨水液面位置 |
| a | 二 (充满) | 10 mL澄清 石灰水 | 二氧化碳 (充满) | 10 mL水 | 左侧液面升高 右侧液面降低 |
| b | 二氧化碳 (充满) | 10 mL澄清 石灰水 | 二氧化碳 (充满) | 10 mLA溶液 | 左侧液面降低 右侧液面升高 |
| c | 0.65 g锌 | 15 mL盐酸 | 0.24 g镁 | 15 mL盐酸 |
① 实验a中,容器Ⅰ中的现象是________,容器Ⅱ中反应的化学方程式是 。
② 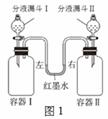 实验b中,根据红墨水液面位置,推测A溶液可能具有
实验b中,根据红墨水液面位置,推测A溶液可能具有
的性质是 。
③ 实验c中,盐酸浓度相同且足量,产生气泡更剧烈的是容
器________(填“Ⅰ”或“Ⅱ”);反应结束并恢复至室温后,红
墨水液面位置是________。
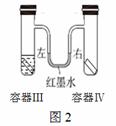 (2)图2所示装置中,容器III、IV体积相同,其中容器Ⅲ中放有植物油,U形管内左右两端红墨水液面相平。实验时分别向III、IV中加入形状和大小相同的铁片,迅速塞紧橡皮塞并放置一段时间。下列说法错误的是 (填字母序号)。
(2)图2所示装置中,容器III、IV体积相同,其中容器Ⅲ中放有植物油,U形管内左右两端红墨水液面相平。实验时分别向III、IV中加入形状和大小相同的铁片,迅速塞紧橡皮塞并放置一段时间。下列说法错误的是 (填字母序号)。
A.植物油用于隔绝氧气和水
B.两支试管中的铁片均被腐蚀
C.U形管右侧液面降低左侧液面升高
D.U形管左侧液面降低右侧液面升高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com