
| A. | 汽油引起的火灾用水基型灭火器扑灭 | |
| B. | 用火碱溶液清洗餐具上的油污 | |
| C. | 井水浑浊时,向其中加明矾可以净水 | |
| D. | 洗发时,在用过洗发剂后再使用护发素 |
分析 A、根据汽油的密度小于水的密度分析;
B、根据火碱具有强腐蚀性分析;
C、根据明矾溶于水后的物质性质进行解答;
D、从弱酸性有益于头发的健康出发考虑.
解答 解:A、汽油难溶于水,且密度比水小,能浮在水面上,水不能使汽油隔绝空气,油随水流动甚至还能扩大着火面积,所以汽油燃烧造成火灾时,不能用水基型灭火器来灭火,故错误;
B、火碱具有强腐蚀性,用火碱溶液清洗餐具上的油污是不合理的,故错误;
C、明矾溶于水后所得体系具有很强的吸附性,可以吸附水中的悬浮杂质,起到净化水的作用,故正确;
D、从弱酸性有益于头发的健康出发,应先用略显碱性的洗发剂;再用略显酸性的护发剂,故正确.
故选:AB
点评 化学来源于生产生活,也必须服务于生产生活,所以与人类生产生活相关的化学知识也是重要的中考热点之一.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 若反应后的溶液的 pH≤7,蒸干后得到的白色固体只有氯化钠 | |
| B. | 向白色固体中滴入稀盐酸,有气泡说明原反应后的溶液 pH>7 | |
| C. | 若反应后的溶液显无色,说明稀盐酸和碳酸钠恰好完全反应 | |
| D. | 当没有气泡产生时,说明稀盐酸和碳酸钠恰好完全反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
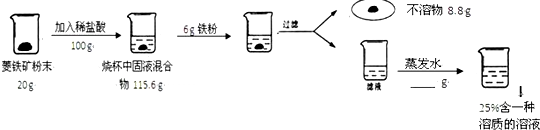
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

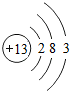 ,该原子在化学反应中易失(填“得”或“失”)电子,形成的离子符号为Al3+铜和稀硫酸不反应,与浓硫酸在一定条件下可以反应,其化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+X↑+2H2O,则X的化学式为SO2.
,该原子在化学反应中易失(填“得”或“失”)电子,形成的离子符号为Al3+铜和稀硫酸不反应,与浓硫酸在一定条件下可以反应,其化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+X↑+2H2O,则X的化学式为SO2.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 青铜是人类最早使用的合金 | |
| B. | 缺钙会引起骨质疏松 | |
| C. | 法国化学家拉瓦锡第一次明确提出空气是由氧气和氮气组成的 | |
| D. | “白色污染”是指白色建筑材料垃圾引起的污染 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com