
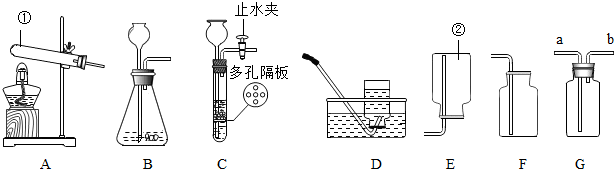
 同学们正在化学实验室完成“实验活动6--酸、碱的化学性质”
同学们正在化学实验室完成“实验活动6--酸、碱的化学性质”分析 根据酸碱的性质以及物质间反应的实验现象进行分析解答即可.
解答 解:【实验探究】
A组:在试管中加入约2mL硫酸铜溶液,然后滴入几滴氢氧化钠溶液,能产生蓝色沉淀.然后再向试管中加入适量稀盐酸,振荡.蓝色沉淀溶解,能证明酸和碱能够发生反应,故填:蓝色沉淀溶解.
【讨论交流】
(1)A组对B组实验中“滴加几滴稀盐酸,没有观察到明显现象”可能是因为溶液中含有氢氧化钠,加入的少量盐酸只与溶液中含有的氢氧化钠反应,而没有与氢氧化铜反反应.使用pH试纸测定溶液的pH,用玻璃棒蘸取上层待测液,涂在pH试纸上,将显示的颜色与标准比色卡对照,故填:HCl+NaOH═NaCl+H2O;用玻璃棒蘸取上层待测液,涂在pH试纸上,将显示的颜色与标准比色卡对照.
(2)B组在试管中继续滴加盐酸,能观察到明显的现象,故填:盐酸.
(3)根据AB组实验可以看出,A中加入的是少量的氢氧化钠,而B中倒入的是大量的氢氧化钠,故填:所加的氢氧化钠的量不同.
【反思评价】
A组与B组同学所用试剂一样,但实验结果不同,最主要的原因是所加试剂的量不同,故填:所加试剂的量不同.
点评 本题考查的是常见的酸和碱的性质探究,完成此题,可以依据已有的知识进行.


科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
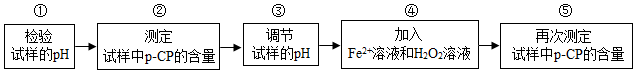
| 实验编号 | 温度/℃ | pH | 测得p-CP的含量随时间变化的关系图 |
| a | 25 | 10 | 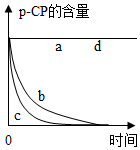 |
| b | 25 | 3 | |
| c | 40 | 3 | |
| d | 40 | 10 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
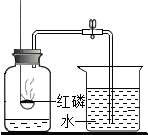 如图是测定空气中氧气含量的实验装置,请根据实验回答问题:
如图是测定空气中氧气含量的实验装置,请根据实验回答问题:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com