

分析 (1)根据铁与硫酸反应放出氢气的特点,根据质量守恒定律,可判断反应前后质量差为恰好完全反应时所产生的氢气质量;
(2)根据反应的化学方程式,由恰好完全反应时生成氢气的质量计算所消耗铁的质量;铁的质量与样品的质量比可计算生铁样品的质量分数;
解答 解:(1)根据质量守恒定律,反应生成的氢气质量=(17.5g+150g)-166.9g=0.6g;
(2)设生铁中铁的质量为x,
Fe+H2SO4═FeSO4+H2↑
56 2
x 0.6g
$\frac{56}{x}=\frac{2}{0.6g}$
解得:x=16.8g,
生铁样品中铁的质量分数=$\frac{16.8g}{17.5g}$×100%=96%
答:(1)生成氢气的质量为0.6g;(2)生铁中铁的质量分数为96%.
点评 根据质量守恒定律,反应后后所得溶液质量=参加反应铁的质量+所加入的稀硫酸的质量-反应放出氢气的质量.


科目:初中化学 来源: 题型:推断题
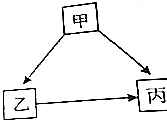 甲、乙、丙皆为初中化学常见物质,有如图所示的转化关系(“→”表示转化关系其它物质和反应条件已略去).
甲、乙、丙皆为初中化学常见物质,有如图所示的转化关系(“→”表示转化关系其它物质和反应条件已略去).查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 某兴趣小组利用如图所示装置测定石灰石样品中碳酸钙的质量分数,探究过程如下(注:石灰石样品中的杂质不参与反应也不溶解);
某兴趣小组利用如图所示装置测定石灰石样品中碳酸钙的质量分数,探究过程如下(注:石灰石样品中的杂质不参与反应也不溶解);查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 诗句中涉及了化学变化 | |
| B. | 诗句中的“丝”含有的物质是维生素 | |
| C. | 诗句中的“灰”指的是蜡烛燃烧产生的CO2等气体和炭粒 | |
| D. | 诗句中的“泪”指的是液态石蜡 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com