
【题目】某研究性学习小组设计了测定纯碱样品(含NaCl杂质)中碳酸钠质量分数的实验方案.请回答下列问题:
(1)碳酸根离子沉淀法.实验步骤:
①用托盘天平称取样品w克放入烧杯中加水溶解;
②加入足量BaCl2溶液充分反应.证明反应后BaCl2剩余的方法是____________;
③过滤、洗涤、干燥、称量沉淀的质量为mg;
④样品中碳酸钠的质量分数为_________________.
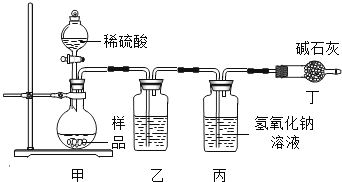
(2)气体法.学习小组利用如图装置测定样品中碳酸钠的质量分数.
①实验装置乙中盛放的试剂为_________,装置丁的作用是________________.
②学习小组通过测量丙装置实验前后的质量.确定二氧化碳的质量.实验中滴加稀硫酸的速度过快,产生的气流过急.会导致测得样品中碳酸钠的质量分数________(填写“偏高”“偏低”或“不变”).
(3)测氯化钠法.请你完成下列实验方案:
称取一定质量的样品放入烧杯中加水溶解:_____________________________________;
过滤、洗涤、干燥、称量沉淀的质量;计算出氯化钠的质量,再得样品中碳酸钠的质量分数.
【答案】 静置,取少量上层清液滴加碳酸钠溶液,有白色沉淀生成,证明氯化钡剩余 ; ![]() ×100% . 浓硫酸 , 防止空气中的二氧化碳和水蒸气进入丙中 偏低 加入足量稀硝酸,再加入足量的硝酸银溶液 ;
×100% . 浓硫酸 , 防止空气中的二氧化碳和水蒸气进入丙中 偏低 加入足量稀硝酸,再加入足量的硝酸银溶液 ;
【解析】本题通过测定纯碱样品(含NaCl杂质)中碳酸钠质量分数考查了酸和盐的性质,气体的检验与除杂方法等。
(1)②氯化钡溶液与碳酸钠溶液反应生成了碳酸钡沉淀和氯化钠。加入足量BaCl2溶液充分反应.证明反应后BaCl2剩余的方法是:静置,取少量上层清液滴加碳酸钠溶液,有白色沉淀生成,证明氯化钡剩余;
(1)设:生成mg的碳酸钡需要的碳酸钠的质量为x
Na2CO3+BaCl2=BaCO3↓+2NaCl
106 197
x mg
![]() x=
x=![]()
样品中碳酸钠的质量分数= 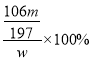 =
=![]() ×100%;
×100%;
(2)①实验装置乙中盛放的试剂为浓硫酸,装置丁的作用是防止空气中的二氧化碳和水蒸气进入丙中;
②实验中滴加稀硫酸的速度过快,产生的气流过急,二氧化碳不能完全被氢氧化钠溶液吸收,导致测得样品中碳酸钠的质量分数偏低;
(3)稀硝酸能与碳酸钠反应生成硝酸钠、水和二氧化碳,足量的稀硝酸可完全除去碳酸钠。硝酸银与氯化钠反应生成氯化银沉淀和硝酸钠,通过氯化银的质量可计算氯化钠的质量,进一步计算出碳酸钠的质量及质量分数。测氯化钠法的操作是:称取一定质量的样品放入烧杯中加水溶解:加入足量稀硝酸,再加入足量的硝酸银溶液,过滤、洗涤、干燥、称量沉淀的质量;计算出氯化钠的质量,再得样品中碳酸钠的质量分数。


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:初中化学 来源: 题型:
【题目】如图是甲、乙、丙三种固体物质的溶解度曲线。下列叙述正确的是
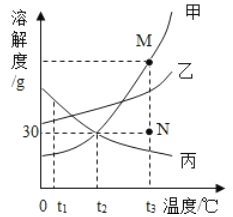
A. t1 ℃时,等质量的甲、乙溶液中所含溶质的质量为乙> 甲
B. t2 ℃时,20 g丙能溶解于50 g水中形成70 g溶液
C. 若要将N点的甲溶液转变为M点的甲溶液,可采取恒温蒸发溶剂的方法
D. t3 ℃时,将甲、乙、丙三种物质的饱和溶液降温至t2 ℃,所得溶液溶质质量分数的大小关系为甲>乙>丙
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某研究小组用下图所示装置,探究能否用镁条代替红磷测定空气中氧气含量。
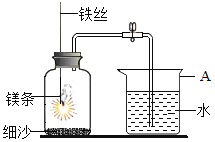
实验前,小组成员提出了不同的猜想。
【猜想与假设】
猜想1:可以代替,因为镁条与氧气反应后不会产生气体
猜想2:不能代替,查阅资料知金属镁很活泼,可能会与空气中的氮气反应
【进行实验】
步骤 | 实验操作 | 实验现象 |
Ⅰ | 组装好装置后,打开止水夹,手捂集气瓶,一段时间后,松开手 | 烧杯中导管口有气泡冒出,松手后,烧杯中导管末端有一段液柱 |
Ⅱ | 关闭止水夹,点燃镁条,迅速伸入集气瓶中,塞好塞子 | 镁条燃烧,放出大量热,发出耀眼白光,生成大量白烟,剩余固体为白色带状物 |
Ⅲ | 冷却至室温,打开止水夹 | 烧杯中水从导管进入集气瓶中,体积约为集气瓶体积的2/5 |
【解释与结论】
(1)Mg与氧气反应的化学方程式为_________。
(2)步骤Ⅰ说明装置的气密性_________。
(3)步骤Ⅱ中,关闭止水夹的目的是_________。
(4)推测猜想2成立的现象证据是_________。
【反思与评价】
(5)该小组认为,即使步骤Ⅲ中水的体积恰好占集气瓶体积的1/5,也不能说明猜想1成立,理由是_________。
(6)小组中同学对镁条与瓶中气体的反应提出了进一步的猜想:甲同学认为镁条先与O2反应,乙同学认为镁条先与N2反应。为进一步检验他们的猜想,可以进行的实验操作是:取少量镁条,点燃后迅速放入盛有空气的集气瓶中,待镁条熄灭后,________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如下图所示,调节杠杆平衡后开始进行实验。
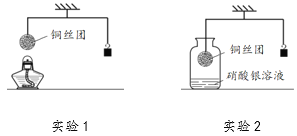
(1)实验1:加热细铜丝团一段时间后移走酒精灯,铜丝变为黑色(CuO),观察到细铜丝团________(填“上升”、“下降”或“不变”),出现上述现象的原因是________。
(2)实验2:将铜丝团浸入硝酸银溶液一段时间,当观察到溶液变为蓝色时小心地松手,发现稳定后的砝码比起始位置高,写出瓶中反应的化学方程式________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】2017年3月15日,央视曝光了另一种“瘦肉精”,其中添加了“人用西药”,如硫酸新霉素![]() 。下列关于硫酸新霉素的说法正确的是( )
。下列关于硫酸新霉素的说法正确的是( )
A. 属于高分子化合物 B. 氢、氧元素的质量比为48:17
C. 碳元素的质量分数最大 D. 1g硫酸新霉素中含有6个氮原子
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】暖贴的发热材料主要有铁粉、活性炭、食盐、水等物质构成。

【提出问题】发热材料中各主要物质起到了什么作业?
【猜想与假设】
Ⅰ、铁粉生锈,发生氧化反应,放出热量。
Ⅱ、活性炭能加快铁粉氧化的速率。
Ⅲ、食盐能加快铁粉氧化的速率
【进行实验】
实验编号 | 实验药品及用量 | 反应时间/min | 温度上升值/°C | ||||
铁粉/g | 活性炭/g | 食盐/g | 水/g | ||||
对照组 | 1 | 0.2 | 0.1 | 5 | 10 | 58 | |
实验组 | 1 | 0 | 0.2 | 0.1 | 5 | 10 | 0 |
2 | 1 | 0 | 0.1 | 5 | 10 | 2.7 | |
3 | 1 | 0.2 | 0.1 | 0 | 10 | 4.5 | |
4 | 1 | 0.2 | 0 | 5 | 10 | 20 | |
【解释与结论】
﹙1﹚铁生锈的条件是_________。
﹙2﹚已知铁粉在一定条件下生锈,发生氧化反应的产物可能是![]() ,该反应的化学方程式为___ 。
,该反应的化学方程式为___ 。
﹙3﹚分析________(填实验编号)的数据,可证明猜想与假设Ⅱ正确。
﹙4﹚分析实验组4与对照组的数据,可证明猜想与假设__________正确。
【反思与评价】
(5)某同学认为没有必要进行实验组Ⅰ,你是否同意他的观点并说明理由:_____________ 。
(6)某同学质疑此实验中忽略了发热材料中的水,你认为分析______________(填实 验编号)的数据,可证明水的作用。【注意:若答对以下小题奖励4分,化学试卷总分布超过60分】
【拓展】
﹙7﹚由上述实验结论分析,铁制品在海边比在内陆锈蚀得要_________(填“更快”或“更慢”)。
﹙8﹚请设计实验验证使用过后的暖贴中是否还含有单铁质:______。(写出实验操作、预期实验现象及结论)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】镁是一种活泼金属,除了能与氧气反应,还能与氮气、二氧化碳等反应。为测定镁铝合金(不含其它元素)中镁的质量分数,称量ag镁铝合金粉末,放在如下图所示装置的惰性电热板上,通电使其充分灼烧。下列关于该实验的说法错误的是
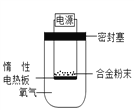
A. 氧气要保证充足
B. 实验结束后一定要再次称量剩余固体质量
C. 用空气代替氧气对实验没有影响
D. 灼烧后的固体为氧化镁和氧化铝的混合物,质量大于ag
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(1)经过一年化学学习.你可能已经喜欢上了在实验室做实验的感觉。让我们一起再来做实验吧
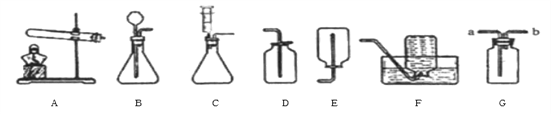
①实验室用装置A制取氧气,若要收集一瓶较纯净的氧气,应选择装置_____(填字母)若用G装置收集氧气,验满方法为_______________;
②通常情况下,乙炔是一种密度比空气略小.且难溶于水的气体。实验室常用块状碳化钙固体和水反应制取乙炔,该反应在常温下进行且非常剧烈。实验室欲制取乙炔,最好选用的装置组合是________(填字母),该发生装置的优点为__________。
(2)化学兴趣小组同学进行中和反应实验时,将4mL2%的稀硫酸 逐滴滴加到2mL2%的氢氧化钠溶液中,测得溶液的pH变化曲线如下图所示。
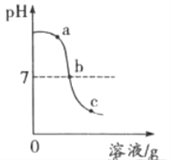
【提出问题】导致溶液pH变化的原因是什么?
【查阅资料】
①溶液的pH是由H+或OH-浓度决定,H+浓度越大,pH越小;OH-浓度越大,pH越大。
②溶液中某种离子浓度非常小时,可忽略不计。
【作出猜想】
猜想Ⅰ:溶液pH变化是因为氢氧化钠溶液被稀释。
猜想Ⅱ:溶液pH变化是因为发生了化学反应。
【进行实验】同学们分成两组分别进行实验。
甲组:同学们将4mL2%的稀硫酸换成__________,逐滴滴加到2mL2%的氢氧化钠溶液中,并测得溶液的pH始终大于7,说明猜想Ⅰ不合理。
乙组:同学们分别取a、b、c三处溶液进行实验。
实验操作 | 实验现象 | 实验分析 |
取适量a处溶液于试管中,加入镁条 | 无气泡产生 | 溶液中几乎不含___(填离子符号) |
取适量b处溶液于试管中,加入紫色石蕊溶液 | _________ | 溶液中几乎不含H+和OH- |
取适量c处溶液于试管中,加入___________ | ___________ | 溶液中几乎不含OH- |
【实验结论】猜想Ⅱ合理。
【知识拓展】从微观角度分析,中和反应的实质是_________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验操作考试考试中为了制取氧气和二氧化碳,实验室提供了以下药品和仪器装置,请回答下列问题:
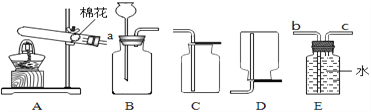
(1)小英同学选择B装置制取氧气,反应的化学方程式为____________,若她选择E装置收集氧气,则将a与________________相连。
(2)小东抽到的实验是制取二氧化碳并检查其性质,他选择的药品是用盐酸和碳酸钙固体反应,若想控制选择的发生装置B的反应速率,他可以将装置中的一种仪器替换为________;他在将得到的气体X通入澄清石灰水中,始终没有发现石灰水变浑浊(装置气密性良好)。
【提出假设】假设一:澄清石灰水已变质:
假设二:气体X中除了有CO2外,还有__________
【实验探究】用下图所示实验探究上述假设是否合理。
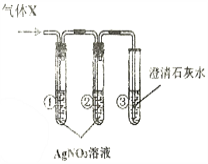
【现象与结论】
实验 | 现象 | 分析与结论 |
一 | 若:试管①中________, 试管②中无明显变化, 试管③中液体变浑浊。 | 试管③中发生反应的化学方程式为_________, 结论:假设二成立。 |
二 | 若:试管①中出现白色沉淀, 试管②中无明显变化, 试管③中无明显变化。 | 试管②中试剂的作用是________, 结论:_______成立。 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com