
| 实验编号 | 试剂 | 产生50mL氢气的 时间(s) | |
| 不同纯度的锌 | 不同体积和浓度的稀硫酸 | ||
| a | 纯锌 | 30 mL 30% | 52 |
| b | 含杂质的锌 | 30 mL 30% | 47 |
| c | 纯锌 | 30 mL 20% | 68 |
| d | 纯锌 | 40 mL 30% | 50 |

| ||
| △ |
| 65 |
| x |
| 2 |
| 0.2g |
| 6.5g |
| 9.3g |
| ||
| △ |
| ||


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:初中化学 来源: 题型:
| A、用蒸馏法制取蒸馏水 |
| B、用肥皂水区分硬水和软水 |
| C、用燃着的木条区别CO2和O2 |
| D、用称取煮沸前后蒸馏水的方法来验证质量守恒定律 |
查看答案和解析>>
科目:初中化学 来源: 题型:
A、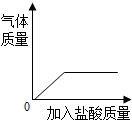 向一定量的大理石中加入足量稀盐酸 |
B、 将1g二氧化锰添加到2.45g氨酸钾中加热制取氧气 |
C、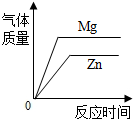 将粗细、形状、质量相同的镁、锌分别投入两份足量的完全相同的稀盐酸中 |
D、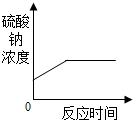 将1g硫酸钠加入一定量的水中做电解水实验 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 实验过程 | 实验现象 | 实验结论 |
| 向盛有5mL5%H2O2溶液的试管中加入少量的HCl,并把带火星的木条放在试管口 | 无明显现象 | (2) |
| 向盛有5mL5%H2O2溶液的试管中加入少量的(1) |
试管中有大量气泡产生,带火星的木条复燃 |
查看答案和解析>>
科目:初中化学 来源: 题型:
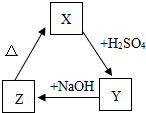 X、Y、Z之间存在如图转化关系:
X、Y、Z之间存在如图转化关系:查看答案和解析>>
科目:初中化学 来源: 题型:
| 主 食 | 米饭、馒头 |
| 副 食 | 烧鱼类、咸鸭蛋 |
| 饮 料 | 牛奶 |
| 我的补充 |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com