
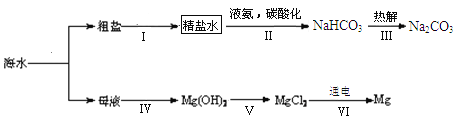
����Ŀ�������������ڹ�ҵ������Ӧ�ù㷺�����ܹ�ע���Ʊ�����������һ��������Ĺ�����ij�о���С��Դ�չ����ϵ���о���
���ø�������Ʊ�
����һ��(1)3K2MnO4+ 2H2SO4=2KMnO4+MnO2��+2K2SO4��2H2O
(2)K2MnO4������ˮ
ʵ���Ҽ��ȸ����������������Ӧ�Ļ�ѧ����ʽΪ_____________���䷴Ӧ������_______������Ӧ��Ĺ���ʣ������ϡ�����ȡһ��ʱ�����ˡ�ϴ�ӡ���ɼ���MnO2����ϡ���������ˮ��ȡ��ԭ����____________��
�����������Ʊ�
���MnSO4��Һ���Ƶû���MnO2��ͬʱ�������������ᣬ�÷�Ӧ�Ļ�ѧ����ʽΪ______��һ��ʱ�����Һ��pH��_______(���������������С���� ��������)
���÷�﮵���Ʊ�
���϶���2Al+2NaOH+2H2O=2NaAlO2+3H2��
�÷�﮵����������(LiMn2O4��̼�۵�Ϳ����������)�Ʊ�����MnO2�����������Դ���գ��������£�
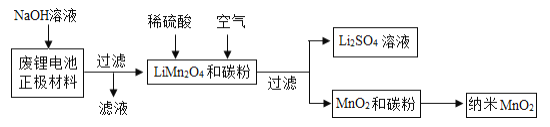
��ش��������⣺
(1)����Һ�������ʵ���Ҫ�ɷ���________ (�ѧʽ)��
(2)��ʵ���ҽ���������������ʱ����Ҫ�IJ����������ձ���©����______��
(3)MnO2��̼�۾�����������Ӧ�Ƶ�����MnO2��
�� 2MnO2+C![]() 2MnO+CO2��
2MnO+CO2��
�� MnO+H2SO4=MnSO4+H2O
�� 3MnSO4+2KMnO4+2H2O=5MnO2��+K2SO4+2H2SO4
�����漰Ԫ�ػ��ϼ۱仯�ķ�Ӧ��_______(�����)��
IV����̼�����Ʊ�
����һ�����¶ȣ�����MnCO3��ȡMnO2��װ�����£�
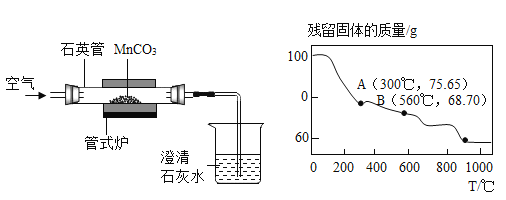
(1)ʵ���й۲쵽����ʯ��ˮ����ǣ�д��ʯӢ���з�����Ӧ�Ļ�ѧ����ʽ___________��
(2)MnCO3�ڿ����м�����ת��Ϊ�̵IJ�ͬ���������������������¶ȵı仯����ͼ��ʾ��ͼ��B���Ӧ����ɷֵĻ�ѧʽΪ______(��д���������)��
���𰸡� 2KMnO4![]() K2MnO4+MnO2+O2�� �ֽⷴӦ ʹ�����ת���õ��������̣���ø���Ķ������� 2H2O+MnSO4ͨ��H2��+H2SO4+MnO2�� ��С NaAlO2 ������ �٢� MnCO3����CO2��+MnO2 Mn2O3
K2MnO4+MnO2+O2�� �ֽⷴӦ ʹ�����ת���õ��������̣���ø���Ķ������� 2H2O+MnSO4ͨ��H2��+H2SO4+MnO2�� ��С NaAlO2 ������ �٢� MnCO3����CO2��+MnO2 Mn2O3
������������ʵ���Ҽ��ȸ�������������Ǹ�������ڼ��ȵ���������������غͶ��������Լ���������Ӧ�Ļ�ѧ����ʽΪ 2KMnO4![]() K2MnO4+MnO2+O2������ʽ��Ϊһ��࣬Ϊ�ֽⷴӦ��������Ϣ��ʾ��32H2O+MnSO4ͨ��H2��+H2SO4+MnO2����������Ӧ��Ĺ���ʣ�������غͶ������̵Ļ�����ϡ�����ȡһ��ʱ�����ˡ�ϴ�ӡ���ɼ���MnO2��ʹ�����ת���õ��������̣���ø���Ķ������̣�������ϡ���������ˮ��ȡ���������MnSO4��Һ���Ƶû���MnO2��ͬʱ�������������ᣬ��Ӧ��Ϊ�����̺�ˮ��������ͨ�磬���ɶ������̺������Լ����ᣬ��Ӧ�Ļ�ѧ����ʽΪ 2H2O+MnSO4ͨ��H2��+H2SO4+MnO2��������ˮԽ��Խ�٣�����Խ��Խ�࣬Ҳ��������������������������Խ��Խǿ����pHԽ��ԽС������һ��ʱ�����Һ��pH�� ��С������(1)����Һ���д��ڿ��������ʣ����Ͼ�﮵���������Ϻ�����������Һ��Ӧ��������Ϣ��2Al+2NaOH+2H2O�T2NaAlO2+3H2��������֪������ƫ�����ƣ��������ʵ���Ҫ�ɷ��� NaAlO2����������ʣ���NaOH��(2)��ʵ���ҽ���������������ʱ����Ҫ�IJ����������ձ���©���� ��������(3)MnO2��̼�۾�����������Ӧ�Ƶ�����MnO2��������Ԫ�صĻ��ϼ�Ϊ�㣬��������Ԫ�صĻ��ϼ۵Ĵ�����Ϊ�㣬��MnCO3����CO2��+MnO2���е��ʲ��뷴Ӧ�������л��ϼ۸ı䣻��MnO+H2SO4�TMnSO4+H2O��Ϊ���ֽⷴӦ�����ϼ۸ı䣻��3MnSO4+2KMnO4+2H2O�T5MnO2��+K2SO4+2H2SO4���������е���Ԫ����+2�仯+4�ۣ�����������е���Ԫ����+7�۱�Ϊ+4�ۣ������л��ϼ۵ĸı䣮�����漰Ԫ�ػ��ϼ۱仯�ķ�Ӧ�� �٢���IV��(1)ʵ���й۲쵽����ʯ��ˮ����ǣ�˵�������˶������̺Ͷ�����̼����Ӧ�Ļ�ѧ����ʽ MnCO3����CO2��+MnO2��(2)MnCO3�ڿ����м�����ת��Ϊ�̵IJ�ͬ���������������������¶ȵı仯��ͼ��ʾ����Ʒ100g��ͼ��B���Ӧ���������Ϊ68.70g������������Ԫ�ص��������䣬100g̼��������Ԫ�ص�����Ϊ100g��
K2MnO4+MnO2+O2������ʽ��Ϊһ��࣬Ϊ�ֽⷴӦ��������Ϣ��ʾ��32H2O+MnSO4ͨ��H2��+H2SO4+MnO2����������Ӧ��Ĺ���ʣ�������غͶ������̵Ļ�����ϡ�����ȡһ��ʱ�����ˡ�ϴ�ӡ���ɼ���MnO2��ʹ�����ת���õ��������̣���ø���Ķ������̣�������ϡ���������ˮ��ȡ���������MnSO4��Һ���Ƶû���MnO2��ͬʱ�������������ᣬ��Ӧ��Ϊ�����̺�ˮ��������ͨ�磬���ɶ������̺������Լ����ᣬ��Ӧ�Ļ�ѧ����ʽΪ 2H2O+MnSO4ͨ��H2��+H2SO4+MnO2��������ˮԽ��Խ�٣�����Խ��Խ�࣬Ҳ��������������������������Խ��Խǿ����pHԽ��ԽС������һ��ʱ�����Һ��pH�� ��С������(1)����Һ���д��ڿ��������ʣ����Ͼ�﮵���������Ϻ�����������Һ��Ӧ��������Ϣ��2Al+2NaOH+2H2O�T2NaAlO2+3H2��������֪������ƫ�����ƣ��������ʵ���Ҫ�ɷ��� NaAlO2����������ʣ���NaOH��(2)��ʵ���ҽ���������������ʱ����Ҫ�IJ����������ձ���©���� ��������(3)MnO2��̼�۾�����������Ӧ�Ƶ�����MnO2��������Ԫ�صĻ��ϼ�Ϊ�㣬��������Ԫ�صĻ��ϼ۵Ĵ�����Ϊ�㣬��MnCO3����CO2��+MnO2���е��ʲ��뷴Ӧ�������л��ϼ۸ı䣻��MnO+H2SO4�TMnSO4+H2O��Ϊ���ֽⷴӦ�����ϼ۸ı䣻��3MnSO4+2KMnO4+2H2O�T5MnO2��+K2SO4+2H2SO4���������е���Ԫ����+2�仯+4�ۣ�����������е���Ԫ����+7�۱�Ϊ+4�ۣ������л��ϼ۵ĸı䣮�����漰Ԫ�ػ��ϼ۱仯�ķ�Ӧ�� �٢���IV��(1)ʵ���й۲쵽����ʯ��ˮ����ǣ�˵�������˶������̺Ͷ�����̼����Ӧ�Ļ�ѧ����ʽ MnCO3����CO2��+MnO2��(2)MnCO3�ڿ����м�����ת��Ϊ�̵IJ�ͬ���������������������¶ȵı仯��ͼ��ʾ����Ʒ100g��ͼ��B���Ӧ���������Ϊ68.70g������������Ԫ�ص��������䣬100g̼��������Ԫ�ص�����Ϊ100g��![]() ����B�����ʺ���Ԫ�ص�����Ϊ68.70g��100g��
����B�����ʺ���Ԫ�ص�����Ϊ68.70g��100g��![]() ���ڹ�������ԭ�Ӻ���ԭ�Ӹ�����Ϊ��
���ڹ�������ԭ�Ӻ���ԭ�Ӹ�����Ϊ��
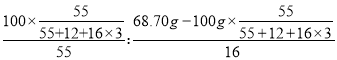 ��2��3�������ɷֵĻ�ѧʽΪMn2O3��
��2��3�������ɷֵĻ�ѧʽΪMn2O3��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ̽������Ҫ��ѧϰ��ʽ���������֤��̽�����̵���Ҫ���ڡ�Ϊ��̽������˿�����ڴ�����������ȼ������ͬѧ�ǽ�һ���������һ������״����˿���������Ǵ�����˿��̼��˿��ĩ�ˣ������̶��������Ӽ�ס����˿����Ȼ����ھƾ����ϵ�ȼ��������˿���ɼ���ƿ�������������룬�۲�����
(1)��ͬѧֻ������˿������һ�£���û�й۲쵽���������ˣ����������˿û��ȼ�յĿ���ԭ����__________________________________________��ֻ��һ������
(2)��ͬѧ��������˿���ڴ�����ȼ���������۲쵽�������䣬���к�ɫ�������ɣ���д���÷�Ӧ�Ļ�ѧ��Ӧʽ��_____________________��
(3)Ϊ���ҳ�����˿���ڴ�����ȼ����������������ԭ��������ʵ����Ʒ������ϸ��˿����̼ϸ��˿��þ��������ƿװ�ļ�ƿ���������ƾ��ơ�������ӵȣ�������ļ������֤�����У�
�ټ���1��_________________����֤������_________________��
�ڼ���2��________________����֤������________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ʵ����ʾ�������;����1766�꣬Ӣ����ѧ�ҿ��ĵ�����п����ϡ�����Ƶ����������������ռ���һֻ������ˮ���е�װ��ˮ��ƿ�У���������������ڷ�ͧ����������ҵ��������Ҫ������������Ӧ��ȡ�����������������Ʊ�����������ȼ��ʱ���ų��������ȣ��ǵ���������ȼ�շ��ȵ�3��������ȼ�պ�IJ�����ˮ�����������Ⱦ������������ڳ�Ϊ���˵���Դ��
(1)���ʵ����ʾ������ʵ���;����д����Ӧ������������(�����ֱ���)
������������ | ��Ӧ�� |
����_____ | ���õ�����ˮ���е�װ��ˮ��ƿ���ռ����� |
����_____ | �����������ڷ�ͧ������������ |
����_____ | ���������ڳ�Ϊ���˵���Դ |
(2)��ȼ����ǰ��Ҫ��_____����������������ȼ�������ܻᷢ����ը����д��������ը�ķ�Ӧ����ʽ_____���÷�Ӧ����������_____
(3)�������ڳ�Ϊ���˵���Դ������Ҫԭ���ǣ�_____(д��һ������)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ҫ����������������Ҫ�ɻ�ѧ�仯�������� ( )
A�����ٶ�ͨ�緢�������� B�����ͨ�緢���Ĺ�
C��ˮ��վ����ˮ�������ĵ��� D��Һ��ʯ����ȼ�շų�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
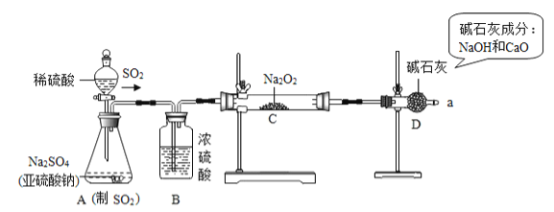
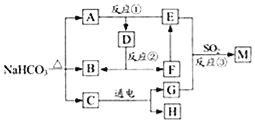
����Ŀ��ijУ���꼶�����ǰ���ѧ���С���ͬѧ��̽���˹�������(Na2O2)���������(SO2)��Ӧ�����ù������ijɷ֣��������£�
���������ϡ������������������Ӧ�Ļ�ѧ����ʽΪ��2SO2+2Na2O2=2Na2SO3+O2��2Na2SO3+O2= 2Na2SO4��SO2��ʹƷ����Һ��ɫ��
��������롿����1������ɷ�ΪNa2SO3
����2������ɷ�ΪNa2SO4
����3������ɷ�Ϊ_________________
��ʵ��̽��������ͼ��ʾ��װ�ý���ʵ�飮��A�з�Һ©���Ļ�������Ӧ����(����������SO2)���ô����ǵ�ľ�������a�����������壬ľ����ȼ��ʵ��ǰ�Ƶ�Na2O2���������Ϊ78g����ַ�Ӧ��Ƶ���������������Ϊ134g��
��ʵ����ۡ�
(1)A����ȡSO2�����װ�ã���Ӧ�Ļ�ѧ����ʽ��ʵ������ȡCO2�Ļ�ѧ����ʽ���ƣ���д��A�з�����Ӧ�Ļ�ѧ����ʽ��____________________________��
(2)������_________________________________________��ʵ�������Ʋ����2�Ǵ���ģ�
(3)װ��B��������_____________��װ��D��������_____________________________��
(4)���ݷ�Ӧǰ�������������ɼ����Na2SO3������Ϊ______g��Na2SO4������Ϊ______g��
���ܽ�������
(1)��ʵ��ǰ�Ƶ�Na2O2���������Ϊm1g����ַ�Ӧ��Ƶ��������������Ϊm2g����m2��ȡֵ��Χ��_____________________(�ú�m1�Ĺ�ϵʽ��ʾ)��
(2)���������һ��ʵ�鷽����������֤�����������������Ӧ�����ù������ijɷ֣�_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С��Ϊ�˲ⶨһ��ʯ��ʯ��̼��Ƶ�������������ʯ��ʯ��Ʒ�гɷ�ĩ��Ȼ��ȡһ������ʯ��ʯ��ĩ�����ϡ�����ַ�Ӧ������ʯ��ʯ�е����ʼȲ����ᷴӦ��Ҳ������ˮ�������ˡ�ϴ�ӡ����������������������ݼ��±���

(1)����Ʒ��̼��Ƶ�����������ƽ��ֵΪ_______�������ȷ��0.1%����
(2)��������ʵ�����ݲ���IJ���ԭ�������______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������̺��ŷḻ����Դ��
(1)��ˮ�����ǽ����ˮ��Դ�������Ҫ���������з����У�����ʹ��ˮ��������____(����ĸ���)��
A����ֽ���� B������ C������ D������
(2)�Ӻ�ˮ��������������ˮ(D2O)����ԭ���ܷ�Ӧ���еļ��ټ��ʹ��Ƚ��ʡ���ˮ������ԭ��(D)�����ԭ��������2������ˮ����Ԫ�ص���������Ϊ_________��
(3)���ú�ˮ��ȡ����ͽ���þ����������ͼ��ʾ���Իش����⣺
��1926���ҹ���ѧ��______�����������Ƽ���ٽ��������Ƽ���ķ�չ����ڢ�Ӧ�Ļ�ѧ����ʽΪ_________��
�ڲ�����������Լ���__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪijЩ���ʼ��ת����ϵ��EΪ�����ļF����ʳƷ�������MΪʯ�����Ҫ�ɷ֣����ַ�Ӧ�������������ȥ��
(1)��ѧʽ��C________��F_________��
(2)��Ӧ�����۵Ļ�ѧ����ʽ��
��_____________________________________________��
��_____________________________________________��
(3)�������������칤�������ú����ʯ�ɻ����ķ�Ӧ��_____(ѡ�Ӧ���)��
(4)��ҵ�Ͽ���B��H�ϳ��Ҵ�(C2H6O)����Ӧ��B��H��������Ϊ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���ҳ�����ͼ��ʾװ�òⶨ����������������
(1)����ʵ��ǰ��������ƿ�ڼ���������ˮ������ˮ���Ϸ��Ŀռ��Ϊ_____�ȷݣ�
(2)��ʵ����Ҫ�������������Ϊ�Ƿ��е�����_____(����������������)�����������_____��
(3)��ȼȼ�ճ��ڵĺ�����������ƿ�в��������������Ⱥ���Ϩ����ȴ���ɼУ����Կ�����������_____��˵�������е������������ˣ����ĵ�����Լռ���������_____��

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com