
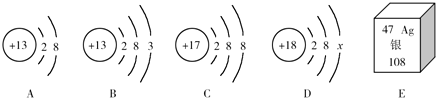
分析 (1)根据同种元素的粒子质子数相同,不同种元素最本质的区别是质子数不同,进行分析解答.
(2)原子中,质子数=核外电子数.
(3)根据图中元素周期表可以获得的信息:左上角的数字表示原子序数,汉字下面的数字表示相对原子质量,进行分析解答即可.
(4)当质子数>核外电子数,为阳离子;当质子数<核外电子数,为阴离子;据此进行分析解答.
解答 解:(1)不同种元素最本质的区别是质子数不同,图中A、B、C、D粒子的核内质子数分别为13、17、18,共表示3种元素.
(2)原子中,质子数=核外电子数,则18=2+8+x x=8.
(3)根据元素周期表中的一格可知,左上角的数字为47,表示原子序数为47;根据原子序数=核电荷数=质子数,则银元素原子的质子数为47;汉字下面的数字表示相对原子质量,银元素的相对原子质量为108.
(4)B质子数=13,核外电子数=10,质子数>核外电子数,为带3个单位正电荷的铝离子;质子数=17,核外电子数=18,质子数<核外电子数,为带1个单位负电荷的氯离子;所形成的化合物为氯化铝,铝元素显+3价,氯元素显-1价,其化学式为:AlCl3.
故答案为:(1)3;(2)8;(3)47;108;(4)AlCl3.
点评 本题难度不大,灵活运用粒子结构示意图的含义、元素周期表中元素的信息(原子序数、元素符号、元素名称、相对原子质量)是正确解答本题的关键.


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 饼干在空气中放置一段时间后变软,说明空气中含有水蒸气 | |
| B. | 常用氮气作食品保护气,是由于氮气的化学性质不活泼 | |
| C. | 氧气用于炼钢,因为氧气可燃 | |
| D. | 稀有气体又叫惰性气体,是因为其化学性质不活泼,可用作保护气 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com