一包氯化钠和硫酸钠的混合物粉末40g,将其全部溶于250g水中,在所得溶液中加入456.6g的氯化钡溶液,恰好完全反应,将所得沉淀滤出、洗涤、干燥,称得其质量为46.6g.试计算:
(1)混合物粉末中硫酸钠的质量分数是多少?
(2)最终所得溶液中溶质的质量分数是多少?
【答案】
分析:在本题中有硫酸钠和氯化钠的混合物,两种物质都易溶于水.当加入一定质量的氯化钡溶液后,氯化钠不反应,硫酸钠和氯化钡反应生成硫酸钡白色沉淀和氯化钠,根据沉淀的质量可以求硫酸钠的质量和新生成的氯化钠的质量.根据质量守恒定律可以求出所得溶液的总质量,然后再根据溶质的质量分数公式求氯化钠的质量分数.
解答:解:设Na
2SO
4的质量为x,反应产生的NaCl质量为y
Na
2SO
4+BaCl
2=BaSO
4↓+2NaCl
142 233 117
x 46.6g y
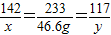
,解题x=28.4g y=23.4g
(1)混合物中Na
2SO
4的质量分数为:

×100%=71%
(2)所得溶液中溶质的质量分数为:

=50%
故答案为:(1)71% (2)50%
点评:本考点既考查了根据化学方程式的计算,又考查了溶质的质量分数和质量守恒定律,综合性比较强.在计算题中始终不要忘记质量守恒定律,做题时还要注意:化学方程式要配平,考虑杂质是否溶于水、是否与加入的物质反应等问题.本考点主要出现在计算题中.

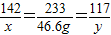 ,解题x=28.4g y=23.4g
,解题x=28.4g y=23.4g ×100%=71%
×100%=71% =50%
=50%
