
(12分)以下是甲、乙两同学对有关镁与盐酸反应的系列研究。
研究一:镁与盐酸反应过程中的能量变化以及反应速率的变化:
(1)反应中试管外壁发烫,说明镁与稀盐酸反应是 反应(填
“吸热”或“放热”)。
(2)实验测得镁片产生气体的速率(v)与时间(t)的关系如图所示,
则t1~t2时间内反应速率逐渐加快的主要原因是 。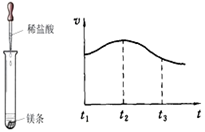
研究二:反应后所得溶液的酸碱性探究:
(3)甲同学反应后用pH试纸测定试管中溶液的酸碱性,发现pH小于7,说明甲同学所得溶
液呈 性(选填“酸”“碱”或“中”)。
甲同学:猜想Ⅰ:稀盐酸过量,使溶液pH小于7;猜想Ⅱ:氯化镁溶液pH小于7。为
验证猜想,甲同学需测定 溶液的酸碱性,实验表明该溶液显弱酸性。
(4)乙同学重复甲同学实验时,发现反应后所得试管中溶液pH大于7。发现实验与甲同学实
验不同的是,反应后的试管中镁条有剩余。乙同学猜想可能是镁与热水反应生成了碱性
物质。乙同学为验证猜想,在滴有两滴酚酞的热水中放入一段打磨过的镁条,观察到溶
液很快变为红色,同时还观察到镁条表面有气体生成,收集并点燃该气体,发现能燃烧,
请根据实验现象写出镁与水反应的化学反应方程式 。
(5)金属氯化物溶液pH值大小与金属的活动性有关,如氯化钠溶液显中性,氯化镁溶液显弱酸性,则氯化钾溶液显 性。
(6)活泼金属能与水在一定条件下反应。实验发现钠与冷水剧烈反应,产生大量的气体。由
此可见金属与水反应与金属的活动性顺序 (填“有关”或“无关”)。
研究三:金属活动性强弱与原子结构的关系:
下图为镁原子、钙原子和钡原子结构示意图。已知其中Ba的活动性最强,据此推测,金属的活动性除与原子的最外层电子数有关,还与 有关。
研究四:确定镁条的成分:
称取3.2g表面被氧化的镁条, 放入100g稀盐酸中恰好完全反应,生成气体0.2g。求:
(7)此镁条中金属镁的质量。(写出计算过程,共3分)
(8)反应后所得溶液中溶质的质量分数 。(计算结果保留一位小数)
研究一:(1) 放热 (2) 镁与稀盐酸反应放热,加快反应速率
研究二:(3) 酸性 氯化镁 (4) Mg +2H2O ="==" Mg(OH) 2↓+H2 ↑
(5)中性 (6)有关
研究三:电子层数
研究四: (7)m(Mg)=2.4g (8) 11.1%
解析试题分析:研究一:(1) 反应中试管外壁发烫,说明镁与稀盐酸反应是放热反应
(2)实验测得镁片产生气体的速率(v)与时间(t)的关系如右图所示,则t1~t2时间内反应速率逐渐加快的主要原因是:镁与稀盐酸反应放热,加快反应速率
研究二:(3)用pH试纸测定试管中溶液的酸碱性,发现pH小于7,说明甲同学所得溶液呈酸性;甲同学:猜想Ⅰ:稀盐酸过量,使溶液pH小于7;猜想Ⅱ:氯化镁溶液pH小于7,因为主要是因为溶液显酸性,所以只要测定氯化镁溶液的酸碱性,实验表明该溶液显弱酸性
(4)在滴有两滴酚酞的热水中放入一段打磨过的镁条,观察到溶液很快变为红色,,说明反应形成了一种碱,同时还观察到镁条表面有气体生成,收集并点燃该气体,发现能燃烧,可以判断是氢气,所以镁与水反应的化学反应方程式:Mg +2H2O ="==" Mg(OH) 2↓+H2 ↑
(5)金属氯化物溶液pH值大小与金属的活动性有关,如氯化钠溶液显中性,氯化镁溶液显弱酸性,从中可以得出结论:金属的活动性越强,形成的金属氯化物溶液显中性,而钾的活动性比钠强,故氯化钾溶液显中性
(6)活泼金属能与水在一定条件下反应。实验发现钠与冷水剧烈反应,产生大量的气体。而金属镁要与热水反应,说明金属与水反应与金属的活动性顺序有关
研究三:金属镁的原子核外有3个电子层,金属钙的原子核外有4个电子层,金属钡的原子核外有6个电子层,而Ba的活动性最强,据此推测,金属的活动性除与原子的最外层电子数有关,还与电子层数有关
研究四:根据反应:Mg+ 2HCl="==" MgCl2 + H2↑中氢气与Mg的质量关系,即可求出镁的质量,还发生了一个反应:MgO+2HCl==MgCl2+H2O, 反应后所得溶液中溶质是MgCl2,先根据方程式,算出MgCl2的质量,再计算溶质的质量分数
解:设金属镁的质量为x,生成MgCl2的质量为y
Mg+ 2HCl="==" MgCl2 + H2↑
24 95 2
X y 0.2g
(7) 24:2=x:0.2g x=2.4g
95:2=y:0.2g y=9.5g
(8)由于MgO的质量=3.2g-2.4g=0.8g,设生成的MgCl2的质量为z
MgO+2HCl==MgCl2+H2O
95
0.8g z
40:95=0.8g:z z=1.9g
故MgCl2的质量的总质量=9.5g+1.9g=11.4g
而溶液的总质量=3.2g+100g-0.2g=103g
溶质的质量分数=11.4g/103g×100%=11.1%
考点:化学反应中的热现象,溶液的酸碱度,化学方程式的书写,金属的活动性,根据化学方程式进行计算


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:初中化学 来源: 题型:问答题
化学与生活息息相关,请你用化学知识回答以下生活中的问题.
(1)碘酒是家庭常备药,碘酒中的溶剂是_________(写化学式)
(2)炎热的夏季自行车车胎容易爆裂,原因是_______________;
(3)铝制品抗腐蚀性能很好,原理是__________________(用化学方程式表示)
(4)现有①黄瓜②豆腐③馒头④鸡蛋,其中富含蛋白质的是_______(填序号)
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
根据下图四个化学实验,回答问题:(提示:Cu与Zn的合金称为黄铜)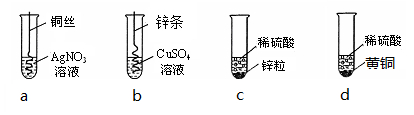
(1)描述实验a中的实验现象 。
(2)要证明Cu、Zn、Ag的活动性顺序,必须要做的实验是 (填实验序号)。
(3)在c实验后的剩余溶液中,一定有的溶质是 ,可能有的溶质是 ,为了确定可能有的溶质,可加入 (填选项序号)
Ⅰ.氯化钡溶液 Ⅱ.氢氧化铜 Ⅲ.氢氧化钠溶液 Ⅳ.锌粒
(4)为了测定d中稀硫酸的溶质质量分数,取20g该黄铜样品于烧杯中,向其中分4次加入该稀硫酸,充分反应。每次所用稀硫酸的质量及剩余固体的质量记录于下表:
| | 加入稀硫酸的质量(g) | 充分反应后剩余固体的质量(g) |
| 第1次 | 25 | 16.75 |
| 第2次 | 25 | 13.5 |
| 第3次 | 25 | m |
| 第4次 | 25 | 12.0 |
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
取铜、锌混合粉末,在空气中充分灼烧后,加入稀硫酸至固体恰好溶解,再加入一定量的铁粉,充分反应后过滤,得到滤渣和滤液.
(1)滤渣中一定有 ;滤液中溶质一定有 .
(2)设计实验方案,探究滤渣成分和与滤渣成分对应的滤液中溶质成分,写出实验操作、预期现象及结论.
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
小聪同学家新换了水龙头,从说明书上了解到该水龙头是铜质镀铬。好奇的小聪想探究铬(Cr)与常见金属铁、铜的活动性强弱,邀请你一同参加。
【知识回放】金属活动性顺序:K Ca Na Mg Al Zn Sn Pb(H) Hg Ag Pt Au,请你在横线上填写对应金属的元素符号。
【作出猜想】猜想1.Cr>Fe>Cu; 猜想2. Fe>Cu >Cr; 猜想3.你的猜想是 。
【查阅资料】(1)铬是银白色有光泽的金属,在空气中其表面能生成抗腐蚀的致密的氧化膜。
(2)铬能与稀硫酸反应,生成蓝色的硫酸亚铬(CrSO4)溶液。
【设计与实验】小聪同学取大小相等的三种金属片,用砂纸打磨光亮;再取三支试管,分别放入等量的同种稀硫酸。
| 实验 | 试管1 | 试管2 | 试管3 |
| 实验 操作 | 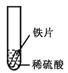 |  | 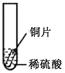 |
| 实验 现象 | 铁片表面产生气泡较慢,溶液变为浅绿色 | 铬片表面产生气泡较快,溶液变成为蓝色 | |
查看答案和解析>>
科目:初中化学 来源: 题型:信息分析题
A是常见金属单质,B、C是非金属单质,且C是密度最小的气体,甲是磁铁矿的主要成分,乙是无色液体,它们之间有如下的转化关系(部分产物和反应条件未标明)。
(1)推断甲、乙的化学式为甲 ,乙 ;
(2)写出反应①的化学方程式 。
查看答案和解析>>
科目:初中化学 来源: 题型:信息分析题
为了达到收旧利废节能减排的目的,从含有金属镁、铁、铜的粉末中,分离和提取出重要化工原料MgSO4和有关金属,实验过程如下:
请回答:
(1)操作①中被磁铁吸引的金属A是 ;金属B是 。
(2)操作b的名称是 ;该操作中需要使用玻璃棒,其作用是 。
(3)写出步骤②所涉及的化学反应方程式: ,该反应的基本类型是 。
(4)实验步骤②中除了加入适量的稀硫酸外,还可选用适量的下列试剂 (填标号)。
a.硫酸铜溶液 b.氯化钠溶液 c.硝酸银溶液
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
化肥对提高农作物的产量具有重要作用,在硝酸钾(KNO3)、硫酸铵[(NH4)2SO4]、尿素[CO(NH2)2]三种化肥中,属于复合肥的是 ,不能与碱性物质混合施用的是 .
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
(6分)盐酸是一种重要的化工原料,也是实验室中重要的化学试剂,初中化学中许多实验都用到了盐酸。
(1)打开浓盐酸的试剂瓶,观察到瓶口有 产生。下列实验中一定不会用到盐酸的是 (填序号)。
A.除去熟石灰中的石灰石 B.鉴别氯化钠和碳酸钠
C.实验室制取二氧化碳 D.除去铁钉上的锈迹
(2)用盐酸按照下图的方式进行中和反应实验,其化学反应方程式是 ,向烧杯中逐滴滴入盐酸至过量的过程中,能够说明盐酸与氢氧化钠发生了化学反应的实验现象是 。以下证明盐酸过量的操作及实验现象的叙述正确的是 (填序号)。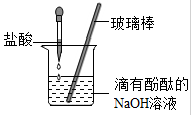
A.滴加石蕊溶液,搅拌后溶液变蓝
B.另滴加氢氧化钠溶液,搅拌后溶液颜色不变
C.加入蒸馏水,搅拌后溶液颜色不变
D.加入金属Cu片,产生气泡
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com