
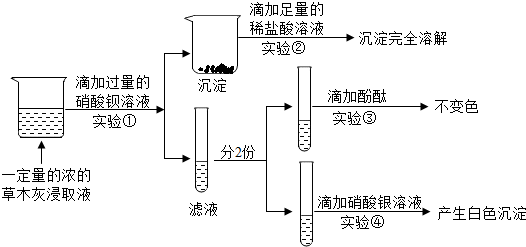
分析 根据硝酸钡和碳酸钾会生成溶于酸的碳酸钡沉淀,和硫酸钾会生成不溶于酸的硫酸钡沉淀,氯离子和银离子会生成氯化银沉淀等知识进行分析.
解答 解:硝酸钡和碳酸钾会生成溶于酸的碳酸钡沉淀,和硫酸钾会生成不溶于酸的硫酸钡沉淀,氯离子和银离子会生成氯化银沉淀,
(1)草木灰的浸取液中滴入硝酸钡生成的白色沉淀完全溶于盐酸,所以混合物中一定不含硫酸钾,一定含有碳酸钾,碳酸钾和硝酸钡反应生成碳酸钡沉淀和硝酸钾,化学方程式为:Ba(NO3)2+K2CO3=2KNO3+BaCO3↓;
(2)通过推导可知,实验②中,沉淀完全溶解,说明草木灰中一定不含K2SO4;
(3)有同学认为实验①可用过量的氯化钡溶液代替过量的硝酸钡溶液,该方法不能,用氯化钡溶液代替硝酸钡溶液,会引入氯离子,干扰了氯化钾的检验;
(4)滤液中滴加硝酸银会生成白色沉淀,所以混合物中含有氯化钾.
故答案为:(1)Ba(NO3)2+K2CO3=2KNO3+BaCO3↓;
(2)K2SO4;
(3)不能,用氯化钡溶液代替硝酸钡溶液,会引入氯离子,干扰了氯化钾的检验;
(4)KCl.
点评 在解此类题时,首先分析题中所给物质的性质和两两之间的反应,然后依据题中的现象判断各物质的存在性,最后进行验证即可.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
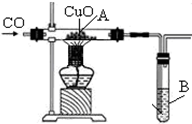 某同学想验证CO具有还原性及还原CuO后所得的产物,用如图装置进行实验
某同学想验证CO具有还原性及还原CuO后所得的产物,用如图装置进行实验查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | 铜是目前世界年产量最高的金属 | |
| B. | 日常使用的金属材料大多数是合金 | |
| C. | 铝是地壳中含量最多的金属元素 | |
| D. | 大多数金属元素在自然界中以单质形式存在 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 影响因素 | 实验设计 | 实验现象 | 实验结论及解释 |
| ①温度 | 装置I放入25℃恒温环境中,装置II放入40℃恒温环境中. | 两套装置中铁钉均锈蚀,且U型管中液面均由b处上升至a处,则所需时间I>II. | 锈蚀的速率I<II;铁的锈蚀速率与反应时的温度有关,温度越高,铁的锈蚀速率越快. |
| ②氧气含量 | 在相同温度下,向I、II两套装置的集气瓶中分别通入氧气和空气. | 铁钉均锈蚀,且U型管中液面由b处上升至a处所需时间I<II. | 铁的锈蚀速率与氧气的含量有关,氧气的含量越多,铁的锈蚀越快. |
| ③水溶液的导电性 | 在相同温度下,装置I集气瓶中加入10mL氯化钠溶液;装置II集气瓶中加入10mL乙醇. | 两套装置中铁钉均锈蚀; 且U型管中液面均由b处上升至a处,则所需时间I<II. | 铁的锈蚀速率与水溶液的导电性有关,在能导电的溶液中,锈蚀的速率加快. |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com