
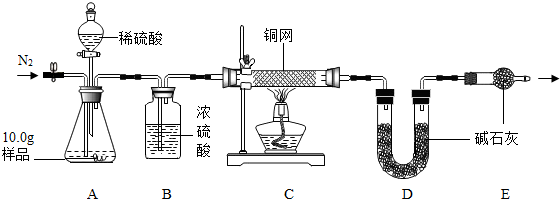
分析 (1)二氧化锰是过氧化氢分解的催化剂,氧气能使带火星的木条复燃;
(2)二氧化碳能使带澄清石灰水变浑浊,此反应可检验二氧化碳的存在;
(3)实验前通氮气是为了除去装置内的空气,以防测定值偏高;实验后还要继续通氮气是为了使残留在装置中的气体全部被吸收;
(4)若先滴入稀硫酸,后加热铜网,将使部分氧气散逸,计算时过氧化氢相对含量偏小,碳酸钠相对含量偏大,导致x:y的值偏大;
(5)C装置中铜网增重1.2g,则说明生成氧气的质量为1.2g,氧气质量占样品的百分数(活性氧含量)为12%;由氧气质量可计算过氧化氢质量为2.55g;D装置增重2.2g说明生成二氧化碳2.2g,计算反应的碳酸钠质量为5.3g,则可得:106x:34y=5.3g:2.55g,故解得x:y=2:3.
解答 解:(1)由结论“说明有O2生成”,再根据:氧气能使带火星的木条复燃,则填复燃;
(2)根据题目中信息“将产生的气体通入澄清石灰水中,出现浑浊现象”,再根据:二氧化碳能使带澄清石灰水变浑浊,则此题结论为有 CO2(或二氧化碳)生成.
(3)实验前通氮气一段时间,加热铜网至红热后,再缓慢滴入过量稀硫酸,直至A中样品完全反应是为了除去装置内的氧气,以防测定值偏高;实验后还要继续通氮气是为了使残留在装置中的气体全部被装置吸收;
(4)根据【组成测定】利用如图装置进行产品中活性氧含量测定和过碳酸钠(xNa2CO3•yH2O2)组成的测定.若先滴入稀硫酸,后加热铜网,将使部分氧气散逸,计算时过氧化氢相对含量偏小,碳酸钠相对含量偏大,导致x:y的值偏大;
(5)C装置中铜网增重1.2g,则说明生成氧气的质量为1.2g,氧气质量占样品的百分数(活性氧含量)为$\frac{1.2g}{10g}$×100%=12%;
因为生成氧气的质量为1.2g,则设需要过氧化氢的质量为x.
2H2O2~O2↑
68 32
x 1.2g
则$\frac{68}{x}=\frac{32}{1.2g}$
解得x=2.55g,故由氧气质量可计算过氧化氢质量为2.55g.
因为D装置增重2.2g说明生成二氧化碳2.2g,则设需要碳酸钠质量为y.
Na2CO3~CO2↑
106 44
y 2.2g
则$\frac{106}{y}=\frac{44}{2.2g}$
解得y=5.3g,故计算反应的碳酸钠质量为5.3g,
根据“产品中活性氧含量测定和过碳酸钠(xNa2CO3•yH2O2)组成”,则可得:106x:34y=5.3g:2.55g,故解得x:y=2:3.
故答案为:
(1)复燃;(2)CO2(或二氧化碳);
(3)使残留在装置中的气体全部被吸收;
(4)偏大;
(5)12%;2:3.
点评 本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.


科目:初中化学 来源: 题型:选择题
| A. | 氧气作氧化剂 | B. | 二氧化碳使澄清石灰水变浑浊 | ||
| C. | 氮气作食品保护气 | D. | 稀有气体用于制作霓虹灯 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 红枣包装中常使用一种袋装防腐剂,品名为“504双吸剂”,其标签如图所示.同学们对一包久置的“504双吸剂”固体样品很好奇,设计实验进行探究.
红枣包装中常使用一种袋装防腐剂,品名为“504双吸剂”,其标签如图所示.同学们对一包久置的“504双吸剂”固体样品很好奇,设计实验进行探究.| 实验操作 | 实验现象 | 实验结论 |
| (1)取少量固体放于试管中,加足量蒸馏水溶解,静置后取上层清液滴加无色酚酞溶液 | 固体溶解时试管外壁发烫,试管底部有不溶物,溶液变红 | 固体中一定含有 和Ca(OH)2. |
| (2)另取少量固体放于试管中,滴加足量的 | 固体逐渐消失,有无色气体产生,得到浅绿色溶液 | 固体中一定含有Fe,一定不含Fe2O3 |
| (3)将步骤(2)中产生的气体通入到澄清石灰水中 | 固体中一定含有CaCO3 |

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
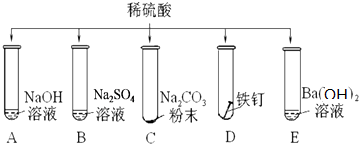
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
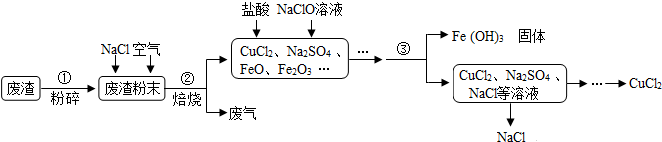
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 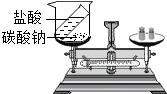 验证质量守恒定律 | |
| B. |  测空气中氧气含量 | |
| C. |  探究物体的吸热能力与哪些因素有关 | |
| D. |  探究导体在磁场中产生电流的条件 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com