
将干燥的铁粉和氧化铁粉末的混合物
30g放入玻璃管中,通入一氧化碳并加热,待氧化铁完全反应后,残留的固体质量是27g,求此混合物中氧化铁的质量是多少? 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:初中化学 来源: 题型:阅读理解

| ||
| ||
| ||
| ||
| ||
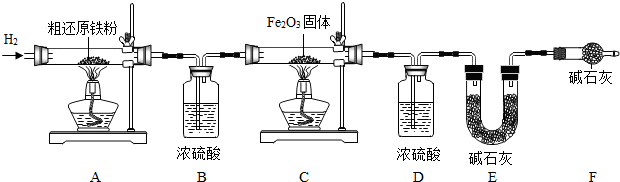
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解

| 实验操作 | 实验现象 | 解释或结论 | |
| 步骤1 | 取A、B两袋“暖宝宝”,A袋按使用说明打开外袋取出内袋;B袋不打开外袋.将两袋样品放置在同样的环境中. | A袋的“暖宝宝”温度很快上升;B袋温度没有明显变化. | “暖宝宝”发热是由于袋内物质与 氧气 氧气 接触. |
| 步骤2 | 24小时后,分别剪开A、B两袋,各取少量袋内物质于甲、乙两支试管中,分别加入足量稀盐酸,充分反应后静置片刻 | 甲中溶液变黄色; 乙中观察到的现象是 部分溶解,产生无色气泡,(溶液为浅绿色) 部分溶解,产生无色气泡,(溶液为浅绿色) . |
24小时后,A袋内物质中一定含有 氧化铁 氧化铁 . |
| 【得出结论】“暖宝宝”发出的热量主要来自铁粉发生氧化(生锈)的过程. | |||

| 时间/小时升时上时高升时度高升时装置高升时 | 0 | 0.5 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 |
| A瓶(盛干燥铁丝) | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| B瓶(盛沾了食盐水的铁丝) | 0 | 0.4 | 1.2 | 3.4 | 5.6 | 7.6 | 9.8 |
| C瓶(盛沾了清水的铁丝) | 0 | 0 | 0 | 0.3 | 0.8 | 2.0 | 3.5 |
| D瓶(盛完全浸没在食盐水中的铁丝) | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| ||
| △ |
| 实验编号 | KClO3/g | 氧化物 | 产生气体的体积(mL) | 耗时(s) |
| 1 | 0.6 | / | 67 | 1800 |
| 2 | 0.6 | 0.2g二氧化锰 | 67 | 36.5 |
| 3 | 0.6 | 67 | 89.5 |
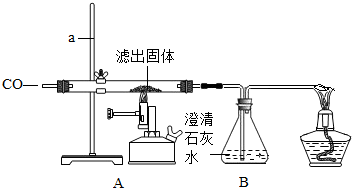
| 装置 | 实验现象 | 实验分析 |
| A | 红色固体全部变黑 | 生成了铁 |
| B | 石灰水变浑浊 | 产生二氧化碳 |
| 铁粉 | 氧化亚铁 | 氧化铁 | 四氧化三铁 | |
| 颜色 | 黑色 | 黑色 | 红色 | 黑色 |
| 磁性 | 有 | 无 | 无 | 有 |
| 与CO反应 | 不反应 | 反应 | 反应 | 反应 |
| 与稀盐酸反应 | 反应 | 生成氯化亚铁和水 | 生成氯化铁和水 | 生成氯化亚铁、氯化铁和水 |
| 与硫酸铜溶液反应 | 反应 | 不反应 | 不反应 | 不反应 |
| 步骤 | 实验操作 | 实验现象 | 结论和解释 |
| 1 | 用磁铁吸引剩余固体 | 剩余固体中没有氧化亚铁. | |
| 2 | 剩余固体中只有铁粉. |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
|
|
②氯酸钾和氯化钾均能溶于水。
【实验一】氧化铁能否在氯酸钾制取氧气实验中加快反应速率。
| 实验编号 | KClO3/g | 氧化物 | 产生气体的体积(mL) | 耗时(s) |
| 1 | 0.6 |
| 67 | 1800 |
| 2 | 0.6 | 0.2g二氧化锰 | 67 | 36.5 |
| 3 | 0.6 | g 氧化铁 | 67 | 89.5 |
⑴实验3中氧化铁的质量为 。
⑵以上实验采用了 的实验方法。
⑶实验一得到的结论是 。
【实验二】为证明氧 化铁是该反应的催化剂,同学们又完成了以下的实验:
化铁是该反应的催化剂,同学们又完成了以下的实验:
Ⅰ.在实验3反应后的混合物中加足量的水溶解,过滤得到红色固体,洗涤干燥并用电子天平称量,质量为0.2g。
Ⅱ.将一定量的CO通入滤出的固体,按下图进行实验:
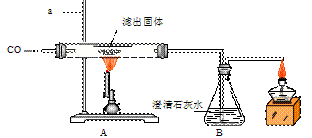
甲同学的实验 报告如下:
报告如下:
| 装置 | 实验现象 | 实验分析 |
| A | 红色固体全部变黑 | 生成了铁 |
| B | 石灰水变浑浊 | 产生二氧化碳 |
⑷写出A中玻璃管内发生反应的化学方程式 。
【实验结论】氧化铁能在氯酸钾制取氧气反应中起催化剂。
【实验反思】乙同学查阅资料发现一氧化碳还原氧化铁后剩余固体可能由氧化亚铁、四氧化三铁、铁粉和未反应的氧化铁中的一种或几种组成。
为了研究剩余固体的成分,丙同学查阅了以下资料:
| 铁粉 | 氧化亚铁 | 氧化铁 | 四氧化三铁 | |
| 颜色 | 黑色 | 黑色 | 红色 | 黑色 |
| 磁性 | 有 | 无 | 无 | 有 |
| 与CO反应 | 不反应 | 反应 | 反应 |
|
| 与稀盐酸反应 | 反应 | 生成氯化亚铁和水 | 生成氯化铁和水 | 生成氯化亚铁、氯化铁和水 |
| 与硫酸铜溶液 | 反应 | 不反应 | 不反应 | 不反应 |
⑸丙同学认为剩余固体中一定没有氧化铁,原因是____________。
⑹测定剩余固体的组成。
| 步骤 | 实验操作 | 实验现象 | 结论和解释 |
| 1 | 用磁铁吸引剩余固体 | _____________ | 剩余固体中没有氧化亚铁。 |
| 2 | __________________ | ______________ | 剩余固体中只有铁粉。 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com