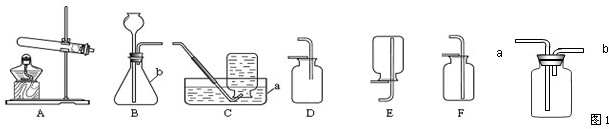
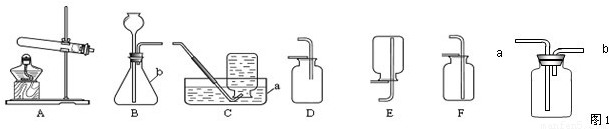
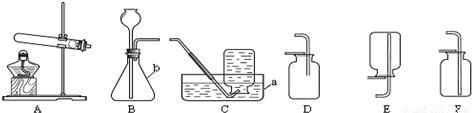
解:(1)图中a是集气瓶;故答案为:集气瓶;
(2)用高锰酸钾制取氧气的反应物是固体,反应条件是加热,所以可选用A作为发生装置;氧气的密度小于空气的密度,并不易溶于水,所以可以C或D收集;化学反应式是:2KMnO
4
K
2MnO
4+MnO
2+O
2↑.
故答案为:A;D;2KMnO
4
K
2MnO
4+MnO
2+O
2↑.
(3)要使装置更加完善,可选用图中的F分液漏斗代替B中的长颈漏斗,因分液漏斗可以控制反应的速率.
故答案为:F;长颈漏斗;可随时控制反应的速度;
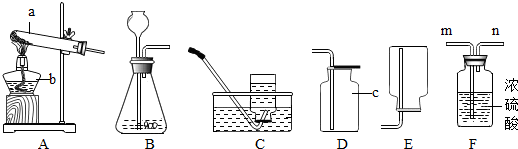
(4)镁屑和稀盐酸过快,无法收集气体,所以不可行;
①A→B整个过程中观察到的现象是:固体溶解,有大量气泡产生,气球胀大;②B→C过程中,我们可以观察到气球变小,说明镁与稀盐酸反应放出了热量,冷却后温度降低气球变小.
故答案为:反应速度太快,不易收集;①固体溶解,有大量气泡产生,气球胀大;②镁与稀盐酸反应放出热量.
分析:(1)熟悉常见仪器,了解名称;
(2)根据用高锰酸钾制取氧气的反应物的状态和反应条件选择发生装置;根据氧气的密度和溶水性选择收集装置;熟记实验室用高锰酸钾制取氧气的化学反应式;
(3)图中的F可以替代B中的长颈漏斗,而且可以控制液体的滴加速度;
(4)根据镁屑和稀盐酸反应过快,气体不易收集,反应过程放出大量的热考虑.
点评:实验室制取气体选择的药品一定要适合,否则会影响实验的效果.如制取二氧化碳是不可选择稀硫酸,因稀硫酸会阻碍反应的进一步进行.


 K2MnO4+MnO2+O2↑.
K2MnO4+MnO2+O2↑. K2MnO4+MnO2+O2↑.
K2MnO4+MnO2+O2↑.