
| A. |  点燃酒精灯 | B. |  检查装置气密性 检查装置气密性 | C. |  取用块状固体 | D. | 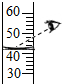 读取体积 |
分析 A、根据酒精灯的使用方法进行分析判断.
B、根据检查装置气密性的方法进行分析判断.
C、根据取用块状固体的方法进行分析判断.
D、根据读取体积的方法进行分析判断.
解答 解:A、不能用燃着的酒精灯点燃另一只酒精灯,要用火柴点燃,图中所示操作错误.
B、检查装置气密性的方法:把导管的一端浸没在水里,双手紧贴容器外壁,若导管口有气泡冒出,装置不漏气;图中所示操作正确.
C、取用块状固体时,先将试管横放,用镊子把固体放在试管口,再让试管慢慢地竖起来,图中所示操作错误.
D、量取液体时,视线要与液体的凹液面最低处保持水平,不能仰视或俯视,图中所示操作错误.
故选:B.
点评 本题难度不大,熟悉各种仪器的用途及使用注意事项、常见化学实验基本操作的注意事项是解答此类试题的关键.


科目:初中化学 来源: 题型:选择题
| A. | KNO3 | B. | Cu(NO3)2 | C. | AgNO3 | D. | 难以确定 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 火焰分三层 | B. | 罩在火焰上方的烧杯内壁出现水珠 | ||
| C. | 点燃蜡烛时,石蜡先融化后燃烧 | D. | 石蜡燃烧时生成二氧化碳和水 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
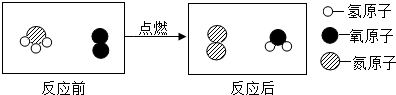 为了减少温室气体排放,人们积极寻找不含碳元素的燃料.经研究发现NH3燃烧的产物没有污染,且释放大量能量,有一定应用前景.下列说法中,正确的是( )
为了减少温室气体排放,人们积极寻找不含碳元素的燃料.经研究发现NH3燃烧的产物没有污染,且释放大量能量,有一定应用前景.下列说法中,正确的是( )| A. | 该化学反应遵循质量守恒定律 | |
| B. | 参加反应的两物质分子个数比为1:1 | |
| C. | 反应后氧元素的化合价升高 | |
| D. | 反应后生成的两种物质均为化合物 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 在天平左右两盘中各方一个等质量的烧杯,烧杯中分别盛有等质量的足量的稀硫酸,天平平衡.向左盘烧杯中加入11g10%的氯化钡溶液,向右盘烧杯中加入镁粉,若天平最终平衡,则加入镁粉的质量为( )
在天平左右两盘中各方一个等质量的烧杯,烧杯中分别盛有等质量的足量的稀硫酸,天平平衡.向左盘烧杯中加入11g10%的氯化钡溶液,向右盘烧杯中加入镁粉,若天平最终平衡,则加入镁粉的质量为( )| A. | 24g | B. | 22g | C. | 12g | D. | 11g |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题


| 样品 | B | D | E | |
| 反应前 | 8g | 350g | 350g | 220g |
| 反应后 | 7.553g | 350.435g | 351.98g | 220.22g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com