

分析 (1)根据高炉炼铁的流程、原料及反应原理分析.先由焦炭制得二氧化碳,再有二氧化碳制得一氧化碳.
(2)最终一氧化碳把赤铁矿中的铁还原出来;
(3)由赤铁矿石的质量、氧化铁的质量分数、生铁中铁的质量分数,根据赤铁矿炼铁的化学方程式可以列式计算出炼出生铁的质量.
(4)根据金属活动性顺序可知,三种金属的活动性顺序为:铁、铜、银,所以向硝酸银和硝酸铜的混合溶液中,加入一定量的铁粉,则铁能与硝酸银反应生成硝酸亚铁和银,能与硝酸铜反应生成硝酸亚铁和铜,向滤渣中滴加稀硫酸,无气泡产生,说明滤渣中一定不含有铁,一定含有银,可能含有铜;滤液中一定含有的溶质是硝酸亚铁进行分析.
解答 解:(1)高炉炼铁的流程为:焦炭与过量空气在高温条件下生成二氧化碳,二氧化碳又与焦炭在高温条件下生成一氧化碳,故填:C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2;CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO;
(2)利用CO的还原性,在高温下和氧化铁反应生成铁和二氧化碳,故填:3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
(3)解:设理论上可炼出含铁98%的生铁质量为x.
Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2
160 112
5000t×80% 98%x
$\frac{160}{112}=\frac{5000t}{98%x}$
x≈2857t
答:该钢铁厂理论上可日产含Fe98%的生铁质量是2857t.
故填:2857;
(4)向硝酸银和硝酸铜的混合溶液中,加入一定量的铁粉,则铁能与硝酸银反应生成硝酸亚铁和银,能与硝酸铜反应生成硝酸亚铁和铜,向滤渣中滴加稀硫酸,无气泡产生,说明滤渣中一定不含有铁,一定含有银,可能含有铜;滤液中一定含有的溶质是硝酸亚铁.
故答案为:Fe;Fe(NO3)2.
点评 活动性强的金属放入活动性弱的金属的混合盐溶液中,活动性强的金属会先把活动性最弱的金属从其盐溶液中置换出来,然后再置换活动性较弱的金属.


 备战中考寒假系列答案
备战中考寒假系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Cl-、NO3-、K+、Na+ | B. | Na+、Cl-、OH-、Mg2+ | ||
| C. | SO42-、NO3-、K+、H+ | D. | Ag+、Cl-、CO32-、K+ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
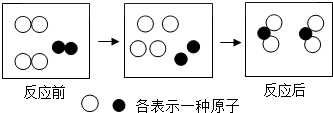
| A. | 反应前共由三个分子,每个分子各由2个原子构成 | |
| B. | 构成物质的分子之间、原子之间均存在一定的间隙 | |
| C. | 化学反应中,分子分成原予,原子重新组成新分子 | |
| D. | 图示反应中,分子数目减少了,违反质量守恒定律 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | NH4H2PO4属于复合肥料 | |
| B. | 从外观即可把磷肥与钾肥区别开来 | |
| C. | 农作物必需的营养元素只有氮、磷和钾三种 | |
| D. | NH4Cl与熟石灰混合研磨有刺激性气味气体放出 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com