
取10.9g纯碱样品(含少量氯化钠杂质)完全溶于108.8g水中,再向其中逐滴加人100g溶质质量分数为20.8%的氯化钡溶液,恰好完全反应,所得溶液为不饱和溶液,请根据题意回答下列问题:
(1)100g溶质质量分数为20.8%的氯化钡溶液中氯化钡的质量为 g;
(2)完全反应后所得溶液中溶质的质量分数为多少? (写出计算过程)。
【答案】(1) 20.8;(2)6.0%
【解析】(1) 100g×20.8%=20.8g;
(2)设20.8gBaCl2恰好与质量为x的Na2CO3反应,生成BaCO3的质量为y,生成NaCl的质量为z,则
Na2CO3+ BaCl2=BaCO3+2NaCl
106 208 197 117
x 20.8g y z
106/ x=208 /20.8g=197/ y=117/ z
解得:x=10.6g;y=19.7g;z=11.7g
则反应后溶液中溶质氯化钠的总质量=(10.9g-10.6g)+11.7g=12.0g
反应后溶液的总质量=10.9g +108.8g +100g-19.7g=200g
反应后所得溶液中溶质的质量分数=12.0g/200g×100%=6.0%
答:100g溶质质量分数为20.8%的氯化钡溶液中氯化钡的质量为20.8g;完全反应后所得溶液中溶质的质量分数为6.0%


科目:初中化学 来源: 题型:
实验室常用草酸(化学式为H2C2O4)和浓硫酸混合加热制备一氧化碳,其反应方程式为:H2C2O4 CO↑+CO2↑+H2O。下图是制备干燥的C
CO↑+CO2↑+H2O。下图是制备干燥的C O,再
O,再 用CO还原氧化铜并检验其反应产物的实验装置。
用CO还原氧化铜并检验其反应产物的实验装置。

 ①从安全角度讲,实验开始时应先加热 (9) (填A或C)处。
①从安全角度讲,实验开始时应先加热 (9) (填A或C)处。
②写出C处反应的化学方程式 (10) ,D处的现象 (11) 。
③为了能正确检验反应后的产物,某同学认为在装置 (12) 和 (12) 之间还应增加个洗气瓶(右图),该同学在洗气瓶中加入的溶液是 (13) 。
④从环保的角度讲,该装置存在的缺陷是 (14) 。
查看答案和解析>>
科目:初中化学 来源: 题型:
乙醇俗称酒精,其化学式为C2H5OH,乙醇中碳、氢、氧三种元素的质最比_____;乙醇中碳元素的质量分数为___________(精确到0.1%);92g乙醇中含碳元素的质量_________________g。
查看答案和解析>>
科目:初中化学 来源: 题型:
实验中学化学兴趣小组为测定某石灰石样品(杂质不溶于水,也不与酸反应)中碳酸钙的质量分数,进行如图所示的实验。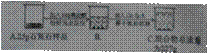
请根据以上信息计算:
(1)样品中碳酸钙的质量分数?
(2)C烧杯中溶液的溶质质量分数?
查看答案和解析>>
科目:初中化学 来源: 题型:
工业上常用NaOH溶液处理铝土矿(主要成分Al2O3),反应的化学方程式:Al2O3+2NaOH=2NaAlO2+H2O。欲对含Al2O3 204 t 的铝土矿进行处理(杂质不参与反应),理论上需要消耗NaOH的质量为多少?
查看答案和解析>>
科目:初中化学 来源: 题型:
向某铁粉样品中,加入溶质质量分数为20﹪的硫酸铜溶液80g,恰好完全反应(样品中杂质不溶于水也不与硫酸铜反应)。请结合下图提供的数据计算:
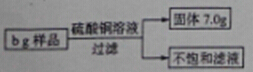
(1)b的数值。
(2)向不饱和溶液中加入120.8g水,求所得溶液中溶质的质量分数。
查看答案和解析>>
科目:初中化学 来源: 题型:
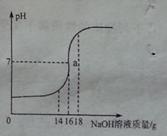
将5%的NaOH溶液逐滴加入到10g稀盐酸中,边加边搅拌,随着NaOH溶液的加入,溶液pH的变化如图所示。边回答:
(1)a点溶液中大量存在的离子有______________。
(2)当恰好完全反应时,消耗NaOH溶液的质量为__________。
(3)计算稀盐酸中溶质的质量分数。
查看答案和解析>>
科目:初中化学 来源: 题型:
某厂烟气中S02的平均含量为0.032 g/L,用780 g硫化钠(Na2S)溶液恰好能吸收2000 L该厂烟气中的SO2,反应的化学方程式为:2Na2S+5SO2+2H20=4NaHSO3+3S↓。
求理论上得到NaHSO3溶液的质量(假设烟气中其他成分不能被吸收)。
查看答案和解析>>
科目:初中化学 来源: 题型:
实验室常用二氧化锰和浓盐酸共热制氯气,反应的化学方程式:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
下列说法正确的是( )
A.反应前后锰元素的化合价不变
B.可以用向上排空气法收集Cl2
C.用浓盐酸配制稀盐酸时,必须用托盘天平、量筒、烧杯和玻璃棒
D.该反应是复分解反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com